
【题目】下列离子方程式书写正确的是
A.碳酸钠溶液中逐滴加入等物质的量的乙酸 CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.二氧化硫通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO
C.用碳棒作电极电解氯化钠饱和溶液 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.碳酸钡溶于氢氟酸 BaCO3+2H+=Ba2++H2O+CO2↑
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
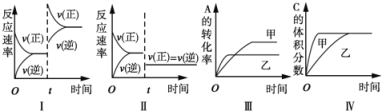
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) ![]() 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)![]() N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
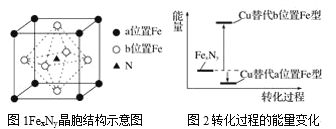
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___。
(3)C、H、O三种元素的电负性由小到大的顺序为____。
(4)乙醇的沸点高于丙酮,这是因为______。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____。
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
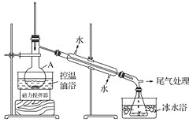
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是___;加入搅拌磁子的目的是搅拌和___。
(2)反应时生成的主要有机副产物有2溴丙烷和____。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL5%Na2CO3溶液,振荡,___,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向恒容密闭容器中充入1molN2与4molH2,发生化学反应N2(g)+3H2(g)![]() 2NH3(g),当反应达到最大限度时,下列说法正确的是( )
2NH3(g),当反应达到最大限度时,下列说法正确的是( )
A.V(N2)=V(NH3)
B.单位时间内,断裂1molN![]() N,同时断裂2molN-H
N,同时断裂2molN-H
C.此时,容器内气体的平均摩尔质量不再变化
D.此时,该反应不一定达到了化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com