
| A. | c(H+) | B. | Ka(HF) | C. | c(HF) | D. | C(OH-) |
分析 根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.
解答 解:A、因HF为弱酸,则浓度为0.1mol•L-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、因HF为弱酸,则浓度为0.1mol•L-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,c(HF)不断减小,故C错误;
D、加水稀释c(H+)不断减小,KW不变,c(OH-)增大,故D正确;
故选D.
点评 本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,本题难点和易错点是不断稀释时水的离子积常数不变,题目难度中等.


科目:高中化学 来源: 题型:解答题
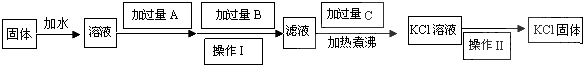
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 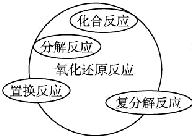 | B. | 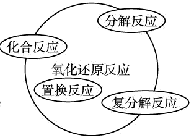 | ||
| C. |  | D. | 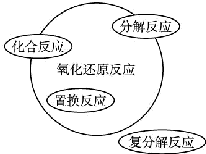 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.5 g | B. | 10.8 g | C. | 6.2 g | D. | 4.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g 氧气所含的原子数为NA | |
| B. | 1.8 g NH4+中含有的质子数NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为3NA | |
| D. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
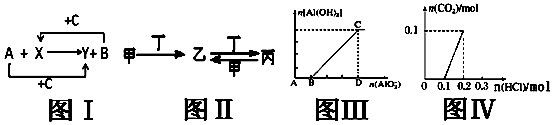
| A. | 关于图Ⅰ,已知C是氧气,X、Y是化合物,则A是钠,B是氢气 | |
| B. | 关于图Ⅱ,已知甲、乙、丙均含有相同的某种元素,若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 关于图Ⅲ,表示NaAlO2溶液逐滴加入到NaOH溶液中,n(Al(OH)3)和n(AlO2-)之间的关系图象 | |
| D. | 关于图Ⅳ,表示各含0.1mol苏打和NaOH混合液中逐滴加入含溶质0.2mol的盐酸的关系图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
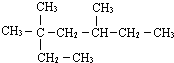 的系统命名法的名称3,3,5,-三甲基庚烷
的系统命名法的名称3,3,5,-三甲基庚烷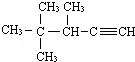 的系统命名法的名称为3,4,4-三甲基-1-戊炔.
的系统命名法的名称为3,4,4-三甲基-1-戊炔. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com