
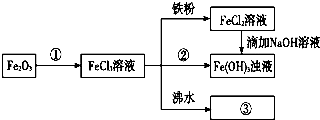
���� Fe2O3�Ǽ�������������ᷴӦ����FeCl3�����Ȼ�����Һ�м���������������ԭ��Ӧ�����Ȼ��������Ȼ�������Һ�еμ�����������Һ������Ӧ����������������ɫ�����������������������������е����������������������������Ȼ�����Һ�м���Ӧ���ɺ��ɫ���������������Ȼ����ڷ�ˮ�м��������ɫ�õ������������壬
��1������Fe2O3������֪ʶ�����������������ᷴӦ�����Ȼ�����ˮ��
��2�����ۿ��Ժ�������֮�䷢��������ԭ��Ӧ�����Ȼ�������
��3��FeCl2��Һ�еμ�NaOH����Fe��OH��3����������������ΪFe��OH��3��
��4�����ˮ����εμӱ���FeCl3��Һ�����Ի�������������壮
��� �⣺��1��Fe2O3�Ǽ�������������ᷴӦ����FeCl3�����ӷ���ʽΪFe2O3+6H+�T2Fe3++3H2O���ʴ�Ϊ��Fe2O3+6H+�T2Fe3++3H2O��
��2�����ۿ��Ժ�������֮�䷢��������ԭ��Ӧ����ѧ����ʽΪ��Fe+2FeCl3�T3FeCl2���ʴ�Ϊ��Fe+2FeCl3�T3FeCl2��
��3��FeCl2��Һ�еμ�NaOH���ɰ�ɫ��Fe��OH��2��Ѹ�ٱ�ɻ���ɫ�����ձ�����Ϊ���ɫ��Fe��OH��3����Ӧ�ķ���ʽΪ��4Fe��OH��2+O2+2H2O�T4Fe��OH��3��
�ʴ�Ϊ�����ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ��4Fe��OH��2+O2+2H2O�T4Fe��OH��3��
��4�����ˮ����εμӱ���FeCl3��Һ����Һ������ĺ��ɫ�����Ի�������������壬��Ӧ�Ļ�ѧ����ʽΪ��FeCl3+3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3�����壩+3HCl��
�ʴ�Ϊ��FeCl3+3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3�����壩+3HCl��
���� �����漰�������Լ����Ļ���������ʷ����֪ʶ��ע��֪ʶ�����������ǽ���Ĺؼ����ѶȲ���


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe3+ | B�� | H+ | C�� | Ba2+ | D�� | Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ϳɰ� | B�� | ������ | C�� | ������ | D�� | �ƴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�0.2molNa2O2�к���0.4NA�������� | |
| B�� | ���³�ѹ�£�0.2molSi������NaOH��Һ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA | |
| C�� | ���ʵ���Ũ��Ϊ0.5mol/L��FeCl3��Һ�У�����Cl-����Ϊ1.5NA | |
| D�� | ���³�ѹ�£�1.06g Na2CO3�к��е�Na+������Ϊ0.02NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢ� | B�� | �٢� | C�� | �ڢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����NN��Ϊ942��O=O��Ϊ500��O-H��Ϊ463�������1mol N-H������������ǣ�������
�йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����NN��Ϊ942��O=O��Ϊ500��O-H��Ϊ463�������1mol N-H������������ǣ�������| A�� | 658 | B�� | 516 | C�� | 391 | D�� | 194 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com