
| A. | 100(2a-b) | B. | 100(2b-a) | C. | 100a | D. | 100b |
分析 二氧化碳和氢氧化钙反应方程式为CO2 +Ca(OH)2=CaCO3↓+H2O、CO2+CaCO3+H2O=Ca(HCO3)2,
当二氧化碳不足量时,根据C原子守恒计算生成c质量;
当二者恰好反应生成碳酸钙时,根据Ca原子守恒计算c质量;
当二氧化碳过量时,二氧化碳比氢氧化钙多出的部分能溶解碳酸钙,据此分析解答.
解答 解:二氧化碳和氢氧化钙反应方程式为CO2 +Ca(OH)2=CaCO3↓+H2O、CO2+CaCO3+H2O=Ca(HCO3)2,
(1)当二氧化碳不足量时,只发生反应CO2 +Ca(OH)2=CaCO3↓+H2O,根据C原子守恒得n(CaCO3)=n(CO2 )=amol,m(CaCO3)=100g/mol×amol=100ag;
(2)当二者恰好反应生成碳酸钙时,根据Ca原子守恒得n(CaCO3)=n[Ca(OH)2]=bmol,m(CaCO3)=100g/mol×bmol=100bg,
(3)当二氧化碳过量时,二氧化碳比氢氧化钙多出的部分能溶解碳酸钙,
CO2 +Ca(OH)2=CaCO3↓+H2O
b b b
CO2+CaCO3+H2O=Ca(HCO3)2,
(a-b) (a-b)
根据两个方程式知,生成沉淀n(CaCO3)=(2b-a)mol,m(CaCO3)=100g/mol×(2b-a)mol=100(2b-a)g,
所以通过以上分析知,c不可能是100(2a-b),故选A.
点评 本题考查化学方程式有关计算,为高频考点,明确物质之间发生的反应是解本题关键,侧重考查学生计算能力、分析物质缜密性等,注意分情况讨论,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 2-乙基-1,3-丁二烯分子的键线: | D. | 四氯化碳分子的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑧⑨⑪ | B. | ②③④⑥ | C. | ⑦⑩⑫⑪⑭ | D. | ①④⑧⑨⑪⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中的中子数为92 | |
| C. | ${\;}_{92}^{235}$U与 ${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
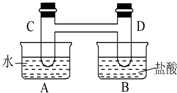 如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:
如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7 | |
| B. | 将0.1mol•L-1氢氧化钠溶液与pH=1稀硫酸等体积混合,混合后的溶液pH<7 | |
| C. | 硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH相同的醋酸钠溶液、碳酸氢钠溶液、碳酸钠溶液,其物质的量浓度: c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com