

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
分析 (1)①已知FeO(s)+CO(g)?Fe(s)+CO2(g)①K1△H1=a kJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)②K2△H2=b kJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)③K3△H3=ckKJ•mol-1
根据盖斯定律①×2+②×$\frac{1}{3}$+③×$\frac{2}{3}$可得Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),据此计算该反应的△H;
②根据图1中温度变化对平衡常数的影响分析反应热,然后判断a、b的大小;
(2)铝热反应需要加热反应才能开始,铝热反应为放热反应,温度升高化学反应速率加快,据此进行解答;
(3)①反应CO(g)+3H2(g)?CH4(g)+H2O(g)为气体体积缩小的可逆反应,达到平衡时正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
②根据v=$\frac{△c}{△t}$计算在0~20min内v (H2);列出平衡常数三段式,根据化学平衡常数的表达式计算;
③该反应为气体体积缩小的反应,压强越大CO的转化率越大,据此判断各压强大小.
解答 解:(1)①已知FeO(s)+CO(g)?Fe(s)+CO2(g)①K1△H1=a kJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)②K2△H2=b kJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)③K3△H3=c kJ•mol-1
根据盖斯定律①×2+②×$\frac{1}{3}$+③×$\frac{2}{3}$可得:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=(a kJ•mol-1)×2+(bkJ•mol-1)×$\frac{1}{3}$+(ckJ•mol-1)×$\frac{2}{3}$=($\frac{6a+b+2c}{3}$) kJ•mol-1,
故答案为:$\frac{6a+b+2c}{3}$;
②由图可知,随着温度的升高,K1增大、K2减小,则反应FeO(s)+CO(g)?Fe(s)+CO2(g)为吸热反应,其△H1>0,3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)为放热反应,△H2<0,所以a>b,
故答案为:>;由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b;
(2)因通过加热引发铝热反应,所以开始速率为零,一旦反应开始,反应不断放热,温度不断升高,化学反应速率加快,故b正确,
故答案为:b;
(3)①发生反应为:CO(g)+3H2(g)?CH4(g)+H2O(g)
a.该反应是气体体积缩小的反应,当容器内压强不再发生变化时,说明正逆反应速率相等,达到平衡状态,故a正确;
b.该反应前后都是气体,气体总质量不变,容器容积不变,则密度始终不变,不能根据密度判断平衡状态,故b错误;
c.v正(CO)=3v逆(H2),表示的是正逆反应速率,但是不满足化学计量数关系,故c错误;
d.混合气体的平均相对分子质量不再发生变化
故答案为:ad;
②20min时n(CO)=0.45mol,CO的物质的量变化为:1mol-0.45mol=0.55mol,该时间段内消耗氢气的物质的量为:0.55mol×3=1.65mol,则在0~20min内v (H2)=$\frac{\frac{1.65mol}{2L}}{20min}$≈0.04 mol•L-1•min-1;
根据表中数据可知,平衡时n(CO)=0.1mol,则:
CO(g)+3H2 (g)?CH4(g)+H2O(g)
初始1mol 3mol 0 0
转化0.9mol 2.7mol 0.9mol 0.9mol
平衡0.1mol 0.3mol 0.9 mol 0.9mol
平衡时各组分浓度为:c(CO)=$\frac{0.1mol}{2L}$=0.05mol/L、c(H2)=$\frac{0.3mol}{2L}$=0.15mol/L、c(CH4)=$\frac{0.9mol}{2L}$=0.45mol/L、c(H2O)=$\frac{0.9mol}{2L}$=0.45mol/L,则该稳定性该反应的平衡常数K=$\frac{0.45×0.45}{0.05×0.1{5}^{3}}$=1200,
故答案为:0.04 mol•L-1•min-1;1200;
③反应CO(g)+3H2(g)?CH4(g)+H2O(g)为气体体积缩小的反应,增大压强后平衡向着正向移动,CO的转化率增大,即压强越大CO的转化率越大,图3中CO的转化率大小为:P1>P2>P3,则压强大小为:P1>P2>P3,
故答案为:P1>P2>P3.
点评 本题考查较为综合,涉及化学平衡计算、化学反应速率的碱性、化学平衡状态的判断、盖斯定律的应用等知识,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠:供氧剂 | B. | 碱石灰:干燥剂 | ||
| C. | 小苏打:发酵粉主要成分 | D. | 纯碱:治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
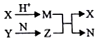 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N<M | B. | .简单离子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | .图中有两个氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com