
| 实验步骤 | 实验现象 |
| ①取少量原溶液,加入稀盐酸, | 产生无色气体,该气体能使澄清的石灰水变浑浊 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 | 有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 | 有白色沉淀生成 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
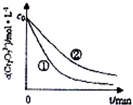
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 15 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生能使石灰水变浑浊的气体,该溶液一定含有CO32- |
| B、向某溶液中滴加氯水后,滴加KSCN溶液,溶液呈红色,该溶液中一定含有Fe2+ |
| C、向某溶液中加入氯化钡溶液,产生不溶于稀盐酸白色沉淀,该溶液一定含有SO42- |
| D、往某溶液中加入NaOH,微热,产生能使湿润的红色石蕊试纸变蓝的气体,该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
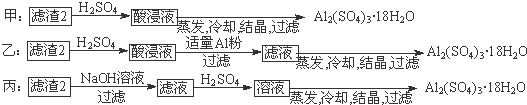
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立; 若未出现血红色,则假设2或假设3成立. |
| 步骤2: | 结合步骤1的现象和结论, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com