
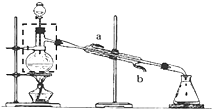
 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:分析 (1)为充分冷凝,使蒸馏水充满冷凝管,则应从下端入;
(2)乙酸和乙醇之间反应生成乙酸乙酯和水;
(3)可提高乙酸的转化率的方法就是促使化学平衡正向移动的方法;
(4)原料乙醇、乙酸易挥发,可能未反应就被蒸出,并且会伴随副反应的发生;
(5)分液漏斗中下层液体从下面漏出,上层液体从上口倒出,据此回答;
(6)乙醇在饱和氯化钙溶液中的溶解度很小,可以用来除去乙醇;
(7)互溶液体的分离采用蒸馏法.
解答 解:(1)为充分冷凝,使蒸馏水充满冷凝管,则应从下端,即b进冷凝水,故答案为:b;
(2)乙酸和乙醇之间反应生成乙酸乙酯和水,即CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(3)可提高乙酸的转化率的方法就是促使化学平衡正向移动的方法,
A.增加乙醇的用量可以使平衡正向移动,故正确;
B.蒸出乙酸乙酯可以使平衡正向移动,故正确;
C.增加乙酸的用量乙酸的转化率降低,故错误;
D.冷凝管中通热水,乙酸的转化率降低,故错误;
故选AB;
(4)原料乙醇、乙酸未反应就被蒸出,发生其他副反应,导致实验所得乙酸乙酯远低于理论产量;
故答案为:原料乙醇、乙酸未反应就被蒸出;发生其他副反应;
(5)为了除去粗产品其中的醋酸,可向产品中加入饱和碳酸钠溶液,乙酸乙酯在上层,下层是无色溶液,下层液体从下面漏出,上层液体从上口倒出,先将水层从分液漏斗的下口放出,再将有机层从上口倒出,故选D.
故答案为:饱和碳酸钠溶液;D;
(6)乙醇在饱和氯化钙溶液中的溶解度很小,可以用此物质来除去乙醇,故答案为:除去乙醇;
(7)加入干燥剂除去其中的水分,整流后可得到纯净的乙酸乙酯,故答案为:蒸馏.
点评 本题考查了乙酸乙酯的制备,综合考查了物质的分离方法,冷凝,产量的分析等,难度适中,考查学生解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO、NO2、SO3、H2O | |
| B. | 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 | |
| C. | 碱:NaOH、Cu2(OH)2CO3、Ba(OH)2、NH3•H2O | |
| D. | 酸:HN3、CH3COOH、H2S、H3PO2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。
①过滤 ②加过量的NaOH ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
其中正确的操作顺序是
A.②⑤④①③ B.④①②⑤③
C.①④②⑤③ D.⑤②①④③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
一定温度下,向一个容积为2 L的真空密闭容器中通入1 mol N2和3 mol H2,3 min后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)为
A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min)  D.0.3 mol/(L·min)
D.0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.用3mL稀硫酸溶液与足量Zn反应,当气泡稀少时加入5mL浓硫酸,又迅速产生较多气泡,由上述操作及现象得出结论:硫酸浓度增大,产生H2的反应速率加快
B.FeCl3+3KSCN Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色
Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色
C.Ba(OH)2·8H 2O与NH4Cl的反应是放热反应
2O与NH4Cl的反应是放热反应
D.化学反应中的能量变化,通常表现为热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
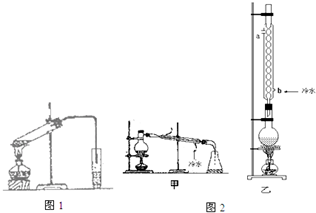 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
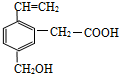 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com