
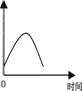
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率速率
可由右上图表示。在下列因素中对产生H2速率有影响的是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①②③ D.②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是
A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O
D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,元素B的原子价电子构型为ns2npn+2 。B、C同周期, C为周期表中电负性最大的元素,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴写出A、B、C、D、E元素符号___、___、___、___、___、
⑵B原子的电子排布图为_________________。D离子的电子排布式为______________________,甲、乙两分子中含有非极性共价键的物质的电子式是___________________,
⑶DBA中的化学键类型为____________、____________属于 化合物(填“离子”或“共价”)
⑷A的硫化物中,A原子以 杂化轨道成键,分子空间构型为 ;
(5)分别写出DBA水溶液与E、DBA与E的氧化物反应的化学方程式.
_____ ______ _______
_______ ______ _______ __
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸分子的结构式为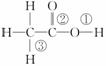 ,下列反应及断键部位正确的是( )
,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂;
(2)乙酸与乙醇发生酯化反应,是②键断裂;
(3)在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2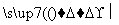 CH2Br—COOH+HBr,是③键断裂;
CH2Br—COOH+HBr,是③键断裂;
(4)乙酸变成乙酸酐的反应: 2CH3COOH―→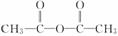 +H2O,是①②键断裂
+H2O,是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4) C.(2)(3)(4) D.(1)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和双原子分子M。(组成E分子的元素的原子序数都小于10,组成G分子的元素为第三周期的元素。)如下图,则下列判断中正确的是
A.常温常压下,L是一种液态有机物 B.E中化学键是极性键
C.G有漂白性 D.上述反应的类型是加成反应

查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池的总反应式是H2+2NiO(OH) 2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
A.NiO(OH) B.Ni(OH)2 C.H2 D.H2和NiO(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应限度的叙述不正确的是
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.达到平衡状态时,反应物的转化率已经最大
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总化学方程式_____________________________________________________________。
(4)用铜作电极电解盐酸溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(5)用Al作电极电解NaOH溶液
阴极反应式_______________________________________________________________;
阳极反应式_______________________________________________________________;
总反应离子方程式_________________________________________________________。
(6)用惰性电极电解熔融MgCl2
阴极反应式_______________________________________________________________;
阳极反应式_______________________________________________________________;
总反应离子方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为___________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸 门上的固体材料R可以采用________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com