
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图12,则总反应的△H 0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。

②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7] | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位)。
科目:高中化学 来源: 题型:解答题
| NO(NO2) | NH4Cl(AlCl3) | FeCl2(FeCl3) | NaNO3(NH4NO3) | |
| 所选试剂化学式 | ||||
| 操作方法编号 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
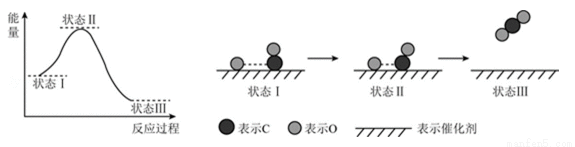
下列说法中正确的是( )
A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.相同条件下,溶液中Fe3+、Zn2+ 、Cu2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com