
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
| ||
| 1 |
| 2 |
| ||


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
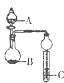
| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、△H1=△H2=△H3=△H4 |
| B、△H1-△H2-△H3=△H4 |
| C、△H1-△H3=△H2-△H4 |
| D、△H1>△H2>△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此法的优点之一是原料来源丰富 |
| B、进行①②③步骤的目的是从海水中提取氯化镁 |
| C、第④步电解制镁是由于镁是很活泼的金属 |
| D、以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com