
| 0.54g |
| 56+35.5x |
| 1 |
| 1+9 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、它能够导电 |
| B、它的pH=0 |
| C、它含有人体所需的矿物质和多种微量元素 |
| D、它清洁、纯净,但长期饮用对人健康无益 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
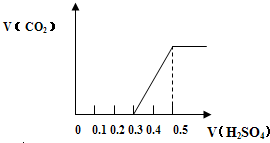 分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=
分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=| m2 |
| m1 |
| 53 |
| 79 |
| 53 |
| 61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com