
| A. | “加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 | |
| B. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 | |
| C. | 医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 | |
| D. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |
分析 A.根据“加碘盐”、“高钙牛奶”、“富硒营养品”等物质中的成分来分析解答;
B.制取铝的方法是电解熔融氧化铝;
C.碳酸钡能与胃酸反应生成可溶性的钡盐,有毒,不能作为钡餐;
D.化学变化是由新物质生成的变化.
解答 解:A.这里的碘、钙、硒存在于无机盐中,是指元素,故A错误;
B.焦炭还原不了金属铝;制取铝的方法是电解熔融氧化铝,故B错误;
C.碳酸钡能与胃酸反应生成可溶性的钡盐,有毒,不能作为钡餐;医疗上进行胃部造影前,患者服用的“钡餐”是硫酸钡,故C错误;
D.“酸可以除锈”,“热的纯碱溶液去油污”都有新物质生成,是化学变化,故D正确.
故选D.
点评 本题考查化学与生产、生活的关系,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
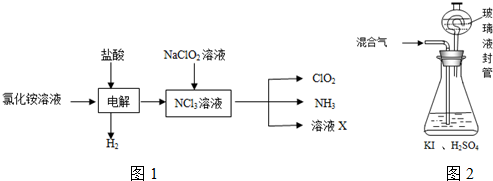
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为
(该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为 ).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )
).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )| A. | CH2=CH2和N2 | B. | CH3-C≡C-NH2 | C. | HC≡C-C≡N | D. | CH2=CH-CH=NH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 在分液漏斗中用酒精萃取碘水中的碘,分液时下层液体从下口放出,上层液体从上口倒出 | |
| C. | 配制浓H2SO4和浓HNO3的混酸时,应将浓H2SO4慢慢加到浓HNO3中,并及时搅拌 | |
| D. | 用蒸发结晶的方法可使NaCl从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. |  用排气法收集氯气 用排气法收集氯气 | |
| D. |  分离互不相溶的两种液体 分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 常温常压下,64g SO2含有的原子数为3NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,用酒精灯直接将水蒸干以获得晶体 | |
| B. | 实验完毕,用坩埚钳取下蒸发皿于实验桌上,不能用手触碰 | |
| C. | 可以加入沸石或碎瓷片代替玻璃棒搅拌 | |
| D. | 蒸发过程中应用玻璃棒不断搅拌以防止液滴飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com