
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H=+b KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
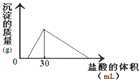
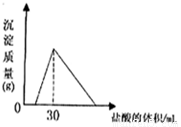
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)

(1)10Al、18H2O=10Al(OH)3、3N2、6OH﹣;5:3
(2)2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(a﹣b﹣c)KJ/mol
(3)2.016
【解析】
试题分析:(1)反应中NO3﹣→N2,N元素化合价由+5价降低为0价,共降低10价,
Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH﹣是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3﹣系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH﹣系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3﹣+10Al+18H2O=10Al(OH)3+3N2+6OH﹣.由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.故答案为:10Al、18H2O=10Al(OH)3、3N2、6OH﹣;5:3.
(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
②Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H=+b KJ/mol
③C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
由盖斯定律可知,②﹣③× +①×得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)
△H=﹣(a﹣b﹣c)KJ/mol.
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(a﹣b﹣c)KJ/mol.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH﹣)+n(AlO2﹣),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH﹣)=1mol/L,n(OH﹣)=0.02L×1mol/L=0.02mol,所以n(AlO2﹣)=0.06mol﹣0.02mol=0.04mol,所以n(Al)=n(AlO2﹣)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.故答案为:2.016.
考点:氧化还原反应;用盖斯定律进行有关反应热的计算;有关混合物反应的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
(1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
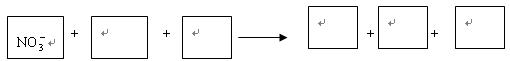
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)= ![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
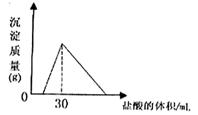
则反应过程中产生氢气的总体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014届云南玉溪一中高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(12分)(1)环境专家认为可以用金属铝将水体中的NO3 - 转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2 +6H2O =4 Al(OH)3 。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s) △H = -2830 kJ/mol
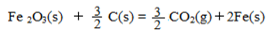 △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
查看答案和解析>>
科目:高中化学 来源:2010届南京一中高三考前冲刺化学卷 题型:填空题
(1)环境专家认为可以用金属铝将水体中的NO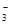 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO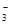 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。
NO3—+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+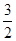 C(s)=
C(s)=
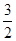 CO2(g)+2Fe(s)
△H=+234.1kJ/mol
CO2(g)+2Fe(s)
△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为 克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com