
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
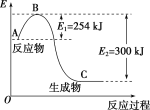
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________。
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及(1)的图中数据计算N—H键的键能为________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________。
【答案】N2(g)+3H2(g)=2NH3(g)ΔH=-92kJ·mol-1 390kJ·mol-1 ![]() 2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)据图可知N2(g)和H2(g)反应生成1molNH3(g)过程中放出300kJ-254kJ=46kJ能量,则反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
(2)设N-H的键能为akJ/mol,△H=反应物键能之和-生成物键能之和=943kJ/mol+3×435kJ/mol-6×akJ/mol=-92kJ/mol,解得a=390 ;
(3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
根据盖斯定律![]() 可得NH3(g)+
可得NH3(g)+![]() NO(g)=
NO(g)=![]() N2(g)+
N2(g)+![]() H2O(g)△H3=
H2O(g)△H3=![]() kJ/mol;
kJ/mol;
(4)氨气在纯氧中燃烧,生成一种单质和水,根据元素守恒可知该单质为N2,所以通入氨气的电极失电子发生氧化反应,电解质溶液显碱性,所以生成N2和H2O,电极反应式为2NH3-6e-+6OH-=N2+6H2O。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;(![]() 被还原为Cr3+)
被还原为Cr3+)
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HC1=KCl+3C12↑+3H2O 中,生成13.44L (标准状况) C12转移电子数为1.2 NA
B. 标准状况下,22.4LC12通入足量水中转移电子数为NA
C. 足量的MnO2与一定量的浓盐酸反应得到1mol Cl2,若向反应后的溶液中加入足量的AgNO3,则生成AgC1的物质的量为2 mol
D. 5.6g Fe 与一定量的稀硝酸反应,转移电子数可能为0.26 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学发展的历史是一部人类逐步深入认识物质组成、结构、变化的历史。随着知识水平的不断提高,人们对化学概念的认识与描述也在不断完善。
(1)初中时,我们将物质与氧气发生的反应称为氧化反应。试从氧化反应的本质上重新定义:________。
(2)燃烧是可燃物与氧气发生的一种发光发热的剧烈的氧化反应。该定义具有一定的局限性,试结合高中所学知识,给燃烧重新定义:________。
(3)电离时生成的阳离子全部是氢离子的化合物叫酸。这是1883年瑞典化学家阿伦尼乌斯(S.Arrhenius)提出的电离学说。试用有关方程式表示氨的水溶液呈弱碱性的原因:______。
1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳里(Lowry)提出了酸碱质子理论。根据酸碱质子理论判断,下列粒子既可看作酸又可看作碱的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. ![]() F.
F. ![]()
(4)1923年路易斯(Lewis)提出了广义的酸碱理论:凡是能给出电子对的物质都是碱;凡是能接受电子对的物质都是酸。如:![]() ,即酸(电子对接受体)+碱(电子对给予体)→产物。试指出下列两个反应中的酸或碱:
,即酸(电子对接受体)+碱(电子对给予体)→产物。试指出下列两个反应中的酸或碱:
①![]() ,该反应中的碱是______(填“
,该反应中的碱是______(填“![]() ”或“
”或“![]() ”)。
”)。
②![]() ,该反应中的酸是______(填“
,该反应中的酸是______(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是( )
①仅用试管、胶头滴管、溴水、KI淀粉溶液就可比较Br2与I2的氧化性的强弱
②利用烧杯、玻璃棒、胶头滴管、分液漏斗及溴水和CCl4能除去NaBr溶液中的少量NaI
③海水提溴与海带提碘均涉及氧化还原反应
④制备粗硅的反应为C+SiO2![]() Si+CO2↑
Si+CO2↑
⑤SiO2与Al2O3均能与强碱溶液反应,所以均为酸性氧化物
⑥光导纤维的成分主要是Si
A.①②③B.②③④
C.②④⑥D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨或铵盐的说法不正确的是
A. 可用湿润的红色石蕊试纸检验氨气
B. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl)
C. NH3属于弱电解质
D. 常温时,0.1 mol·L1NH4Cl溶液加水稀释,![]() 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中,不断通入HCl气体
溶液中,不断通入HCl气体![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到
,得到![]() 和
和![]() 与pH的变化关系如图所示,则下列说法不正确的是
与pH的变化关系如图所示,则下列说法不正确的是![]()
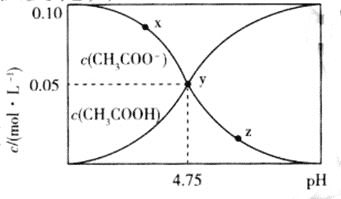
A.溶液中水的电离程度:![]()
B.在y点时,通入的HCl气体在标准状况下的体积为![]()
C.随着HCl的通入, 不断减小
不断减小
D.该温度下,![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,有
时,有![]() 的一组醋酸和醋酸钠的混合溶液,溶液中
的一组醋酸和醋酸钠的混合溶液,溶液中![]() 、
、![]() 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是 ![]()
![]()
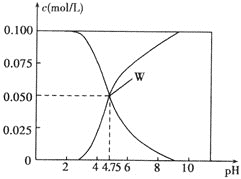
A.![]() 的溶液中:
的溶液中:![]()
B.该温度下醋酸的电离平衡常数为![]()
C.![]() 的溶液中:
的溶液中:![]()
D.向W点所表示的溶液中加入等体积的![]() 溶液:
溶液:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com