
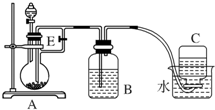
 ��ͼ��ʾװ�ÿ�������ȡFe��OH��2�۲�Fe��OH��2�ڿ����б�����ʱ����ɫ�仯��ʵ���ṩ���Լ�����м��6mol/L������Һ��NaOH��Һ������˵��������ǣ�������
��ͼ��ʾװ�ÿ�������ȡFe��OH��2�۲�Fe��OH��2�ڿ����б�����ʱ����ɫ�仯��ʵ���ṩ���Լ�����м��6mol/L������Һ��NaOH��Һ������˵��������ǣ�������| A�� | B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ�����м | |
| B�� | ʵ�鿪ʼʱӦ�Ƚ�����E�ر� | |
| C�� | ����Fe��OH��2�IJ���Ϊ���ر�E��ʹA����Һѹ��Bƿ�� | |
| D�� | ȡ��װ��B�е���Ƥ����ʹ�������룬�йط�Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��2+O2+2H2O�T4Fe��OH��3 |
���� A����ȡ����������Ҫ��м����������ƿ��Ӧ���ȼ�����м��
B������ϡ���ᷴӦ���������������������÷�Ӧ�����������ɣ�Ӧ�Ƚ�����E��
C���رջ���E����������ѹǿʹFeSO4��Һ��ѹ��Bƿ�н��з�Ӧ��
D���������������ȶ������ױ������е�����������������������
��� �⣺A����ȡ����������Ҫ��м����������ƿ��Ӧ���ȼ�����м������A��ӦԤ�ȼ�����Լ�����м����A��ȷ��
B��ϡ���������Ӧ����������������������Ϊ���������ɣ����������E������ɰ�ȫ�¹ʣ�����Ҫ����E����B����
C���������ᷴӦ���������ɣ��رջ���E������Aװ����������������ѹǿ������ʹFeSO4��Һ��ѹ��Bƿ�н��з�Ӧ�������������������Բ���Ϊ���رջ���E��ʹFeSO4��Һ��ѹ��Bƿ�н��з�Ӧ����C��ȷ��
D���������������ȶ������ױ������е������������ɺ��ɫ��������������Ӧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3����D��ȷ��
��ѡB��
���� ���⿼������������������ȡ���ѶȲ����������������ױ�����������������ȡ����������ʱע��������������������½��з�Ӧ�����Ǹ��л�ѧ�н���Ҫ��һ��ʵ�飬��ѧϰ���ص㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ö��Ե缫���MgCl2��Һ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2�� | |
| B�� | ��NaClO��Һ�еμ�����FeSO4��Һ��5ClO-+2Fe2++5H2O�T4HClO+Cl-+2Fe��OH��3�� | |
| C�� | ��NH4HCO3ϡ��Һ�еμӹ���Ca��OH��2��Һ��NH4++HCO3-+2OH-�TNH3•H2O+CO32-+H2O | |
| D�� | ��CuSO4��Һ�еμӹ�����ˮ��Cu2++2 NH3•H2O�TCu��OH��2��+2 NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
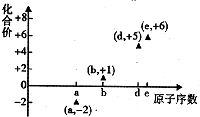 ��ͼ���۷ֶ�����Ԫ�ص�ԭ����������ij�ֳ������ϼ۵Ĺ�ϵͼ������ԭ��������������Ӧ��Ԫ�أ�������˵����ȷ���ǣ�������
��ͼ���۷ֶ�����Ԫ�ص�ԭ����������ij�ֳ������ϼ۵Ĺ�ϵͼ������ԭ��������������Ӧ��Ԫ�أ�������˵����ȷ���ǣ�������| A�� | 31d��33d����ͬ�ֺ��� | B�� | ��һ������d��e���縺��d��e | ||
| C�� | ��̬�⻯����ȶ��ԣ�a��d��e | D�� | a��b�γɵĻ����ﲻ���ܺ����ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | C | CO | C2H6 | C2H5OH |
| ȼ����/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܽ⡢���� | B�� | ��ȡ������ | C�� | ��Һ������ | D�� | ��ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.3mol | B�� | 0.4mol | C�� | 0.5mol | D�� | 0.6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
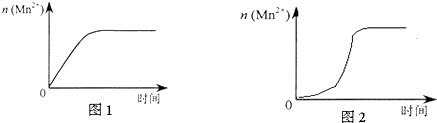
| ʵ���� | �����£��Թ��������Լ���������/mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ��/min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���� | B�� | ���� | C�� | ��ϩ | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{r��Ca��}{r��Mg��}$ | B�� | $\frac{r��C{l}^{-}��}{r��A{l}^{3+}��}$ | C�� | $\frac{r��Na��}{r��Mg��}$ | D�� | $\frac{r��N{a}^{+}��}{r��{F}^{-}��}$ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com