
【题目】为综合利用高浓度磷复肥工业的副产品磷石膏![]() 主要成分为
主要成分为![]() ,进行的研究如下:
,进行的研究如下:
![]() 一定条件下,
一定条件下,![]() 的脱水反应相关的热化学方程式如下:
的脱水反应相关的热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
则该条件下反应![]() 的
的![]() ________
________![]() 。
。
![]() 作还原剂与磷石膏的反应为
作还原剂与磷石膏的反应为![]()
![]() 。向盛有
。向盛有![]() 的
的![]() 真空恒容密闭容器中充入
真空恒容密闭容器中充入![]() ,反应体系起始总压强为
,反应体系起始总压强为![]() ,在
,在![]() 下,固体物质的物质的量随时间变化的关系如图1所示。
下,固体物质的物质的量随时间变化的关系如图1所示。
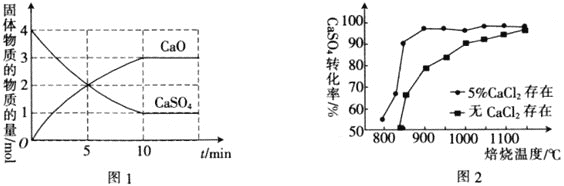
![]() 内,
内,![]() ________。
________。
![]() 达到平衡时,CO的转化率为________。
达到平衡时,CO的转化率为________。
![]() 该反应的压强平衡常数
该反应的压强平衡常数![]() ________
________![]() 用含a的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 以高硫煤为还原剂焙烧磷石膏,可将
以高硫煤为还原剂焙烧磷石膏,可将![]() 还原,得到的
还原,得到的![]() 可用于工业生产硫酸。图2为熔烧
可用于工业生产硫酸。图2为熔烧![]() 小时内
小时内![]() 对硫酸钙转化率的影响图像,焙烧温度达到
对硫酸钙转化率的影响图像,焙烧温度达到![]() 之前,使用
之前,使用![]() 可以________
可以________![]() 填“提高”“降低”或“不影响”
填“提高”“降低”或“不影响”![]() 的转化率。
的转化率。
![]() 利用反应
利用反应![]() 可将磷石膏转化为硫酸铵。
可将磷石膏转化为硫酸铵。
![]() 已知:氨水
已知:氨水![]() ,碳酸
,碳酸![]() ,
,![]() 。则
。则![]() 溶液显________
溶液显________![]() 填“酸性”“碱性”或“中性”
填“酸性”“碱性”或“中性”![]() 。
。
![]() 的
的![]() 溶液显酸性的原因是________
溶液显酸性的原因是________![]() 用离子方程式表示
用离子方程式表示![]() ,溶液中
,溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
【答案】![]()
![]()
![]()
![]() 提高 碱性
提高 碱性 ![]()
![]()
【解析】
(1)根据盖斯定律进行计算;
(2)![]() 根据
根据![]() 计算;
计算;
![]() 根据平衡时氧化钙的物质的量推算出剩余一氧化碳的量,继而计算转化率;
根据平衡时氧化钙的物质的量推算出剩余一氧化碳的量,继而计算转化率;
![]() 根据
根据![]() 计算;
计算;
(3)根据图2可知在焙烧温度达到![]() 之前,5%CaCl2存在的情况下比无
之前,5%CaCl2存在的情况下比无![]() 存在时
存在时![]() 的转化率高
的转化率高
(4)![]() 铵根水解显酸性,碳酸根水解显碱性,根据所给条件计算二者水解平衡常数,谁大显谁性;
铵根水解显酸性,碳酸根水解显碱性,根据所给条件计算二者水解平衡常数,谁大显谁性;
![]() 铵根水解显酸性,根据电荷守恒进行分析。
铵根水解显酸性,根据电荷守恒进行分析。
![]() 已知
已知![]()
![]()
将![]() 得
得![]() ,故答案为:-44;
,故答案为:-44;
![]() 内,CaO生成2mol,则生成
内,CaO生成2mol,则生成![]() 为2mol,则
为2mol,则![]() ;故答案为:
;故答案为:![]() ;
;
![]() 为3mol,
为3mol,![]() 为3mol,剩余CO为2mol,CO转化率
为3mol,剩余CO为2mol,CO转化率![]() ;故答案为:60%;
;故答案为:60%;
![]() 平衡时
平衡时![]() 为3mol,
为3mol,![]() 为3mol,CO为2mol,
为3mol,CO为2mol,![]() 占
占![]() ,
,![]() 占
占![]() ,CO占
,CO占![]() ,起始压强为
,起始压强为![]() ,对应物质的量为5mol,则平衡总压强为
,对应物质的量为5mol,则平衡总压强为![]() ,则
,则 ;故答案为:0.09a;
;故答案为:0.09a;
![]() 由图2可知,在焙烧温度达到
由图2可知,在焙烧温度达到![]() 之前,5%CaCl2存在的情况下比无
之前,5%CaCl2存在的情况下比无![]() 存在时
存在时![]() 的转化率高;给答案为:提高;
的转化率高;给答案为:提高;
![]() 由盐类水解规律和
由盐类水解规律和![]() 可知,碳酸根离子水解程度大于铵根离子的水解程度,溶液显碱性;故答案为:碱性;
可知,碳酸根离子水解程度大于铵根离子的水解程度,溶液显碱性;故答案为:碱性;
![]() 硫酸铵溶液中铵根离子水解,
硫酸铵溶液中铵根离子水解,![]() ,
,![]() ,溶液显酸性;由电荷守恒
,溶液显酸性;由电荷守恒![]() 和
和![]() ,可知溶液中
,可知溶液中![]() 小于
小于![]() ;故答案为:
;故答案为:![]() ;
;![]() 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
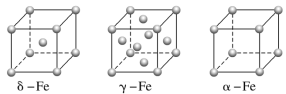
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__,δ、α两种晶胞中铁原子的配位数之比为__。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__(填晶体类型)。
(3)铜晶体中铜原子的堆积方式为__,晶胞中原子的空间利用率为__。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是___(填“CuCl2”或“CuCl”)的晶胞,其中Cl-的配位数为__。
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于__(填“离子”或“共价”)化合物。
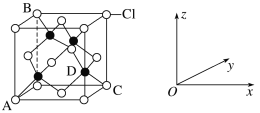
③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应8NH3+3Cl2→N2+6NH4Cl的相关描述中正确的是
A.N2的电子式是 ![]()
B.反应物和生成物的化学键类型相同
C.每生成11.2 L N2,转移电子数为3 NA
D.还原剂与还原产物的物质的量之比是1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)以下说法不正确的是(__________)
A.0~1min的平均反应速率大于3~4min的平均反应速率
B.达到平衡时H2的转化率为75%
C. 在其它条件不变时,若提高反应的温度正反应速率增大,逆反应速率减小
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常数为K,虚线I对应条件下平衡常数为K1,虚线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是____。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:
物质的化学式 | CH3COOH | H2CO3 | |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则(NH4)2CO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0.lmolL﹣1乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中![]() =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03mol/(L·min)
B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.17mol/(L·min )
D.v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D. 结构简式为![]() 的一溴代物有5种
的一溴代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某离子晶体晶胞如下图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为d g/cm3。下列说法中正确的是
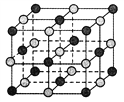
A. 晶体晶胞中阴、阳离子的个数都为1
B. 该晶体中两个距离最近的同种离子的核间距为![]() cm
cm
C. 其中阴、阳离子的配位数都是4
D. 该晶胞可能是NaCl的晶胞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平衡体系Ca(OH)2(s) ![]() Ca2++2OH -中,能使c(Ca2+)减小,而使c(OH -)增大的是:( )
Ca2++2OH -中,能使c(Ca2+)减小,而使c(OH -)增大的是:( )
A.加入少量MgCl2固体B.加入少量Na2CO3固体
C.加入少量KCl固体D.加入少量Ca(OH)2固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com