
下列能够检验出KI中是否含有Br-的实验是 ( )。
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMnO4溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成,则含有Br-
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.质子数相同的原子,其核外电子排布也相同
B.质量数相同的不同原子,其化学性质一定相同
C.金属性越强,其原子在反应中越易失去电子
D.非金属性越强,其阴离子越难失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式: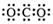 B.Cl-的结构示意图:
B.Cl-的结构示意图:
C.乙醇的结构式:CH3CH2OH D.乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池,放电时的总反应为Fe+Ni2O3+3H2O==Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,负极为Fe
B.电池放电过程中,正极附近溶液的pH增大
C.电池放电时,电解质溶液中OH-移向正极
D.电池放电时,负极反应为Fe+2OH--2e-==Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是 ( )。
A.从海水中提取溴时,不涉及氧化还原反应
B.苯与溴水反应生成溴苯
C.可以用CCl4萃取溴水中的溴
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与含氯化合物有关的说法正确的是 ( )。
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________ _________________________________________________________。
 ③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________ _________________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )。
A.3 mol·L-1盐酸 B.4 mol·L-1 HNO3溶液
C.5 mol·L-1 NaOH溶液 D.18.4 mol·L-1 H2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com