
| 实验目的 | 实验操作 | |
| A | 制取乙酸乙酯,提高其效率 | 加热,将乙酸乙酯蒸出 |
| B | 比较Mg、Al的金属性 | 分别将打磨过的镁带、铝片放入沸水中 |
| C | 羟基影响与其相连的苯环活性 | 分别将饱和溴水滴入苯和苯酚溶液中 |
| D | 制备Fe2O3固体 | 将H2O(g)通入装有铁粉的试管,加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.反应为可逆反应,减少乙酸乙酯平衡向着正向移动;
B.金属性越强,与水反应越剧烈;
C.受羟基的影响,苯酚中苯环上H原子变得比较活泼;
D.铁粉与水蒸气在高温下反应生成四氧化三铁和氢气.
解答 解:A.反应为可逆反应,及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动,可提高乙酸乙酯的制备效率,故A正确;
B.分别将打磨过的镁带、铝片放入沸水中,根据与水反应的剧烈程度可比较Mg、Al的金属性,故B正确;
C.分别将饱和溴水滴入苯和苯酚溶液中,苯不反应,苯酚中苯环H被取代,说明羟基影响与其相连的苯环活性,故C正确;
D.将H2O(g)通入装有铁粉的试管,加热后生成的是四氧化三铁,无法制备Fe2O3,故D错误;
故选D.
点评 本题考查化学实验方案的评价,题目难度中等,涉及化学平衡及其影响、有机物结构与性质、金属性强弱比较、物质制备等知识,明确常见元素及其化合物性质为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(稀) | B. | N2+O2 | C. | NH4Cl+O2 | D. | NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的金属性依次减弱 | B. | H2S、H2O、HF的稳定性依次减弱 | ||
| C. | Cl-、Br-、I- 还原性依次增强 | D. | Na、K、Rb的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
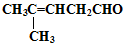 检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为
检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为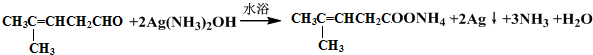 或
或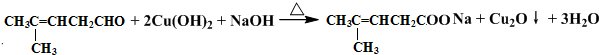 ;
;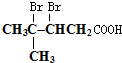 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
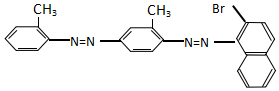
| A. | 不能发生加成反应 | B. | 属于甲苯同系物 | ||
| C. | 属于芳香烃 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,产生白色沉淀,则原溶液中一定有SO42- | |
| B. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中一定有Cl-? | |
| C. | 用光洁的铂丝蘸取某无色溶液,在酒精灯外焰里灼烧时观察到黄色火焰,则原溶液中一定有Na+ | |
| D. | 向某溶液中加入碳酸钠溶液,产生白色沉淀,再滴入稀盐酸,沉淀溶解,则原溶液中一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径X>Y>Z | |
| B. | 离子半径Ym->Xn+>Zm+ | |
| C. | 三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X,Z,Y | |
| D. | Y在自然界中没有游离态,可形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH4+ | |
| C. | 由水电离出的c(OH-)=1×10-12mol•L-1溶液中:NH4+、HCO3-、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14的溶液中:K+、Na+、I-、SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com