
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ||||||||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ |
 ,
, ;
;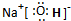 ,
,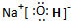 ;
;

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
| Z | ||
| W | X | Y |
| A、Y的最高价氧化物的水化物是强酸 |
| B、W的最高价氧化物能溶于烧碱溶液 |
| C、Z的氧化物只有一种 |
| D、X的最高正价是+5价 |
查看答案和解析>>
科目:高中化学 来源:喀什第二中学2008-2009学年高一年级第二学期第二次月考化学试题 题型:022
下表是元素周期的一部分,针对表中元素,填写下列空白.
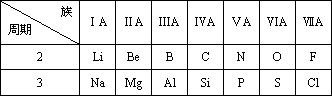
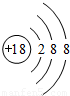
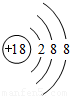
(1)Al3+的结构示意图为________.
(2)NaCl的电子式为________.
(3)F、Cl、S的氢化物中稳定性最强的是________(填氢化物名称)
(4)用化学式表示N、P的最高价氧化物的水化物的酸性________>________.
(5)Na、Al的最高价氧化物的水化物之间反应的化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期的一部分,其中所列字母分别代表某一元素。
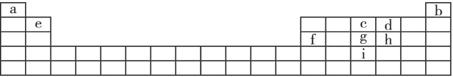
请根据表中所列a—i九种元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多并且原子半径最小的元素的价电子层的电子排布式________________;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子杂化方式______________,所形成简单分子的立体构型为______________,该分子为______________分子(填“极性”或“非极性”)。
(2)d、g、i分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期的一部分,其中所列字母分别代表某一元素。
| a | b | ||||||||||||||||
| e | c | d | |||||||||||||||
| f | g | h | |||||||||||||||
| j | |||||||||||||||||
请根据表中所列元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多的元素是 (填写表中字母);写出其价电子的轨道表示式 ;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子以sp3形式杂化,所形成简单分子的立体构型为 ,该分子为 分子(填“极性”或“非极性”)。
(2)写出j元素基态原子的电子排布式 ;d、g、j分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为 (填化学式)。
(3)可用来组成酸、碱、盐三类物质至少需要的元素有 (填写表中字母);e、f单质及ef合金中硬度由大到小的顺序为 (填写名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期的一部分,其中所列字母分别代表某一元素。
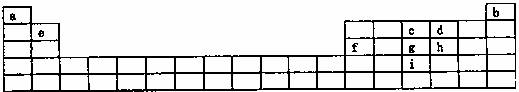
请根据表中所列a i九种元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多并且原子半径最小的元素的价电子层的电子排布式 ;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子杂化方式 ,所形成简单分子的立体构型为 ,该分子为 分子(填“极性”或“非极性”)。
(2)d、g、I分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为
(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com