
| A. | 先加BaCl2,再加入HCl | B. | 先加HNO3,再加BaCl2 | ||
| C. | 先加H2SO4,再加BaCl2 | D. | 先加HCl,再加BaCl2 |
分析 检验溶液中是否存在硫酸根离子,应该先加入稀盐酸,没有明显现象,据此排除能够与氯化钡产生白色沉淀的银离子、碳酸根离子、亚硫酸根离子的干扰,然后再加入氯化钡溶液,若生成了白色沉淀,说明溶液中存在硫酸根离子,否则不存在硫酸根离子.
解答 解:A、若先加入氯化钡溶液,生成的沉淀可能为氯化银沉淀,无法判断是否存在硫酸根离子,故A错误;
B、先加入稀硝酸,溶液中若有亚硫酸根离子,稀硝酸能够将亚硫酸根离子氧化成硫酸根离子,所以无法证明溶液中是否存在硫酸根离子,故B错误;
C、加入硫酸,引进了硫酸根离子,无法证明溶液中是否存在硫酸根离子,故C错误;
D、先加入盐酸,没有明显现象,再加入氯化钡溶液,若生成了白色沉淀,证明溶液中一定存在硫酸根离子,故D正确;
故选D.
点评 本题考查了常见离子的检验方法,题目难度不大,注意熟练掌握常见离子的检验方法,注意检验硫酸根离子时,一定要排除干扰离子;试题培养了学生灵活应用所学知识解决实际问题的能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 | |
| B. | 若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 | |
| C. | 若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 | |
| D. | 平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
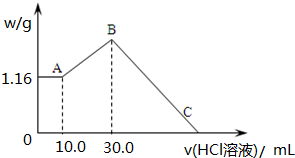
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 3mol铁与足量的水蒸气充分反应,转移8NA个电子 | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
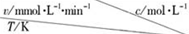 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=7.50 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b>318.2 | |
| D. | 温度为b时,蔗糖浓度减少一半所需的时间比318.2K时短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Cu生成的一极是阴极,发生氧化反应 | |
| B. | 反应中转移电子的物质的量为0.4 mol | |
| C. | 在另一极得到O2的体积(标准状况)是1.12 L | |
| D. | 电解一段时间后,溶液的pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com