
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列说法正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列含碳元素的化合物中,不属于有机物的是
( )
A.氰化钠(NaCN) B.醋酸(CH3COOH)
C.丙烷(CH3CH2CH3) D.碳化硅(SiC)
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气可用于消灭田鼠,为此,可将氯气用软管通到田鼠洞中,这是利用了氯气下列性质中的( )
①黄绿色 ②密度比空气大 ③有毒 ④易液化
⑤溶于水
A.①② B.②③
C.①②③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
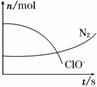 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO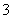 、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO- , 还原产物是HCO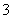
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.若生成2.24 L N2(标准状况),则转移电子0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定能在下列溶液中大量共存的离子组是( )
①含有大量Al3+的溶液中:Na+、NH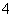 、SO
、SO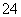 、Cl-
、Cl-
②加入Al能放出H2的溶液中:Cl-、HCO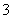 、SO
、SO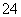 、NH
、NH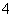
③含有大量Fe3+的溶液中:Na+、Mg2+、NO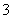 、SCN-
、SCN-
④在含有大量AlO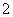 的溶液中:NH
的溶液中:NH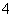 、Na+、Cl-、H+
、Na+、Cl-、H+
⑤由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca 2+、K+、Cl-、HCO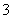
A.①② B.①③⑤
C.① D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q弱
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构相同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
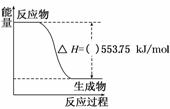
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+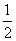 O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO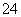 ,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
________________________________________________________________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:
________________________________、________________________________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:
_________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com