
����Ŀ����һ������X����ˮ��ҺΪdz��ɫ���ɷ������µ�ת����ϵ(���ַ�Ӧ�����������)������B��D��E��F��Ϊ��ɫ���壬M��LΪ�����Ľ������ʣ�CΪ������ˮ�ĺ��ɫ���塣�ڻ��Һ�м���BaCl2��Һ�����ɲ�����ϡ����İ�ɫ������H��M��Ӧ�ɷų��������ȡ���ش��������⣺
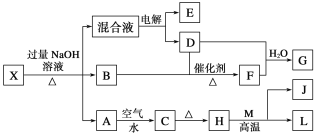
��1��B�ĵ���ʽΪ____________��
��2�������Һʱ������ӦʽΪ_______________________��
��3��д��L���ڷ����ڳ�ʪ�����еĸ�ʴԭ����
������___________________________________��
������___________________________________��
�ܷ�Ӧ��______________________________________________________��
��4����֪a g E������D����ȫȼ�������ȶ��Ļ�����ʱ���ų�b kJ��������д��E����ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________________��
���𰸡�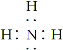 4OH����4e��= O2����2H2O Fe �C 2e- = Fe2+ O2 + 2H2O + 4e- = 4OH- 2Fe��O2��2H2O = 2Fe(OH)2 H2(g)��
4OH����4e��= O2����2H2O Fe �C 2e- = Fe2+ O2 + 2H2O + 4e- = 4OH- 2Fe��O2��2H2O = 2Fe(OH)2 H2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1
kJ��mol��1
��������
M��LΪ�����Ľ������ʣ�H��M��Ӧ�ɷų��������ȣ��÷�ӦΪ���ȷ�Ӧ����MΪAl��LΪFe��CΪ������ˮ�ĺ��ɫ���壬��CΪFe(OH)3��HΪFe2O3��Ȼ����ת����ϵͼ��֪��AΪFe(OH)2��x��ˮ��ҺΪdz��ɫ�����Һ�к��������ƺ������������ƣ������м���BaCl2��Һ�����ɲ�����ϡ����İ�ɫ����������Ϊ���ᱵ��B��D��E��F��Ϊ��ɫ���壬BӦΪ��������XΪ(NH4)2Fe(SO4)2�������������Һ����EΪH2��DΪO2��������������Ӧ����FΪNO��NO��������ˮ��Ӧ����GΪ���ᣬ��Ȼ�������ʵ����ʼ���ѧ���������
���ݷ����ã�
��1��BΪ�����������ʽΪ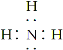 ����Ϊ��
������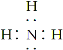 ��
��
��2����������ƺ��������ƵĻ��Һʱ�����������������ӷŵ磬�缫��ӦʽΪ40H����4e��=O2����2H2O����Ϊ
40H����4e��=O2����2H2O��
��3���ڳ�ʪ�Ļ����У�������������̼���γ�����-����-ˮ������С��ԭ��أ�������������ʴ���ɴ�֪���������������ĵ缫��ӦʽΪ��Fe �C 2e- = Fe2+�����������ĵ缫��ӦʽΪ��O2 + 2H2O + 4e- = 4OH-���ܷ�ӦʽΪ��2Fe��O2��2H2O = 2Fe(OH)2
��4��agH2������O2����ȫȼ�������ȶ��Ļ�����ʱ���ų�b kJ����������1mol Eȼ�շų�![]() ���������Ȼ�ѧ��ӦΪH2(g)��
���������Ȼ�ѧ��ӦΪH2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1��
kJ��mol��1��
����H2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1
kJ��mol��1



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
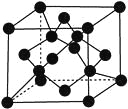
����Ŀ��ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��һ��1��2���⻯������м�����������������������ԭ�ӹ�ƽ�棻Z��L������2��δ�ɶԵ��ӣ�Qԭ�ӵ�s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϣ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӡ�
(1)Yԭ�Ӻ����________�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬Tԭ����________�ֲ�ͬ�ܼ��ĵ��ӡ�
(2)X��Y��Z�ĵ�һ��������С�����˳��Ϊ_______________(��Ԫ�ط��ű�ʾ)��
(3)��X��Y��Z�γɵ�����ZXY����XZ2��Ϊ�ȵ����壬��ZXY����Xԭ�ӵ��ӻ��������Ϊ_______________________��
(4)Z��R���γɻ�����ף�1 mol���к�________mol��ѧ������������ᷴӦ��������ķ��ӿռ乹�ͷֱ�Ϊ___________________��
(5)G��Q��R��������۵����±�������۵�����ԭ��Ϊ_________________��
������ | G�ķ����� | Q�ķ����� | R�ķ����� |
�۵�/K | 993 | 1539 | 183 |
(6)��T����������Һ����μ���Y���⻯���ˮ��Һ����������Ӧ�����ӷ���ʽΪ___________��
(7)X���ʵľ�����ͼ��ʾ��һ��X��������________��Xԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ�ڴ�������ķ�Ӧ���̼������仯��ͼ��ʾ������˵����ȷ����
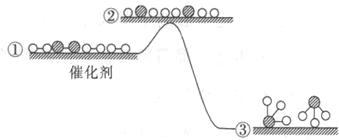
A.����ѹǿ��������֮���������ֵ������
B.�ϳɰ������淴Ӧ���ʱ���ͬ
C.�ϳɰ��Ĺ��������ȷ�Ӧ
D.��ʹ�ô��������ɵ�����NH3��Ҫ��ʱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ����
A.pH��8��CH3COONa��Һ��c��CH3COOH����9.9��10��7 mol��L��1
B.0.1 mol��L��1Na2SO3��Һ��c��Na������c��H������c��SO32������c��HSO3������c��OH����
C.0.1 mol��L��1NaHCO3��Һ��c��Na������c��OH������c��HCO3������c��H2CO3����c��H����
D.0.1 mol��L��1CH3COONa��Һ��ͨ��HCl����ҺpH��7��c��Na����>c��CH3COOH��>c��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶ȡ�ѹǿ�£����ܱ�������Ͷ��һ����N2��H2��������Ӧ��N2��3H2![]() 2NH3 ��H<0��
2NH3 ��H<0��
��1����Ӧ��ʼ�Σ�v������_______������>����<������������v���棩�����v������________������������������С������ͬ����v���棩��_______����Ӧ�ﵽƽ��ʱ��v������_______������>����<������������v���棩��
��2���ﵽƽ���������Ӧ������v��N2����ʾ���淴Ӧ������v����H2����ʾ����v��N2����____v����H2����
��3�����д�ʩ���ܼӿ췴Ӧ���ʲ����������ת���ʵ���_______������ĸ����
A ������������ʱ��ѹ��������� B ������������ʱ�����߷�Ӧ��ϵ�¶�
C ʹ�ú��ʵĴ��� D ��������������䣬����һ�����ĵ���
��4��ʵ��������������Ҫ���¶ȿ�����һ�����ʵķ�Χ�������¶Ȳ��˹���Ҳ���˹��͵�ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����״���£���500 L��������ˮ�γ�1 L��ˮ����˰�ˮ�����ʵ���Ũ��Ϊ__mol�� L-1��������λ��Ч���֣�����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ__��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ__��
���з�Ӧ�еİ��백�������еİ�������ͬ����__��
A��2Na+2NH3===2NaNH2+H2�� B��2NH3+3CuO===3Cu+N2+3H2O
C��4NH3+6NO===5N2+6H2O D��HNO3+NH3===NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH��===NO2-+NO3-+H2O��NO+NO2+2OH��===������+H2O����ƽ�÷���ʽ����______________
��3����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500 mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1 L 1 mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2 g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ__��
��Cu��Cu2O �����ʵ���֮��Ϊ__��
��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
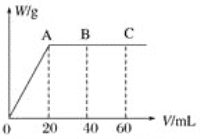
��4����H2SO4��HNO3�Ļ����Һ20 mL������0.25 molL��1Ba��OH��2��Һʱ�����ɳ���������w��g����Ba��OH��2��Һ�����V��mL���Ĺ�ϵ��ͼ��ʾ��C ����Һ�����ԣ�����ԭ���Һ��H2SO4�����ʵ���Ũ��Ϊ__mol��L-1��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������£�a������X��b������Y�ķ�������ͬ������˵��������ǣ�������
A.X��Y��ʽ��֮����a��b
B.����X������Y���ܶȱ�Ϊb��a
C.1g����X��1g����Y�ķ�����֮����a��b
D.1mol����X��1mol����Y����������a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����![]() ���Ȼ���XCl2 0.95g�����Һ������1mol/L����������Һ20mL���ܰ���������ȫ�����������Լ��㣺
���Ȼ���XCl2 0.95g�����Һ������1mol/L����������Һ20mL���ܰ���������ȫ�����������Լ��㣺
(1)X��������Ϊ_________��
(2)��X�ĺ���������Ϊ12����47.5gXCl2���������ӵ����ʵ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����20mLŨ�Ⱦ�Ϊ0.1mo1/L��MOH��NH3��H2O���Һ�еμ�0.1mol��CH3COOH��Һ����û��Һ�ĵ����ʣ���ʾ�������Ե��������������CH3COOH��Һ�������V���Ĺ�ϵ��ͼ��ʾ����֪CH3COOH��Ka��1.8��10��5��NH3��H2O��Kb=1.8��10��5������˵��������ǣ� ��
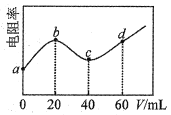
A.MOH��ǿ��
B.c����Һ��Ũ�ȣ�c��CH3COOH)<c(NH3��H2O��
C.d����Һ������
D.a��d������ˮ�ĵ���̶���������С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com