
| 1mol×1 |
| 2 |
| 1mol×2 |
| 2 |
| 1mol×3 |
| 2 |
| 1g×2 |
| 46 |
| 1 |
| 23 |
| 1g×2 |
| 24 |
| 1 |
| 12 |
| 1g×6 |
| 54 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1mol×2 |
| 1 |
| 1mol×2 |
| 2 |
| 1mol×2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
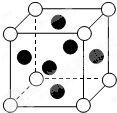 【物质结构与性质】
【物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:

| 电离能/KJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | D | E | F | G |
| 所有原子中半径最小 | 基态原子核外只有三个能级,且各能级电子数相等 | 由D形成的两种单质,其中之一是地球生物的“保护伞” | 短周期中第一电离能量小 | 单质为淡黄色晶体,不溶于水,微溶于酒精 | 最外层只有一个电子,次外层填满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1=Q2=57.3 |
| B、Q1>Q2>57.3 |
| C、Q1<Q2=57.3 |
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com