
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |

分析 已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)分析Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li2CO3最易沉淀.
解答 解:已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,故答案为:增加样品与H2SO4的接触面积,加快化学反应速率;
(2)已知Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1,在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,所以除去的离子为Al3+、Fe3+,故答案为:石灰石;Al3+;Fe3+;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入适量Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,故答案为:2Li++CO32-=Li2CO3↓.
点评 本题考查了物质分离提纯实验操作,涉及离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等,考查考生运用金属元素的有关知识分析解决问题的能力,题目难度中等,以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 200 mL 0.25mol/L CaCl2溶液 | B. | 200 mL 0.25mol/L HCl溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 100 mL 0.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | 苯乙酮 | 苯 | 乙酸 | 水 |
| 沸点℃ | 202 | 80 | 118 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
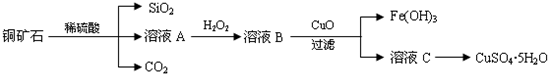
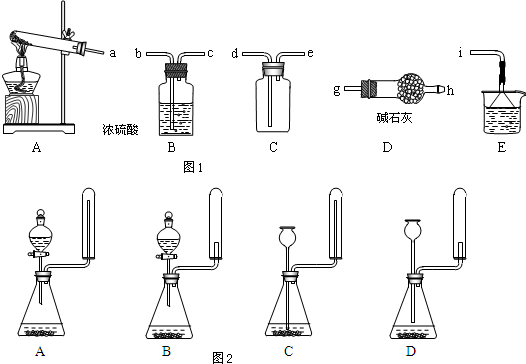
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 烧瓶内溶液由橙黄色变为无色 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 主要仪器 | 试剂 | |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com