
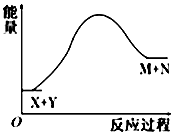
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
分析 由图象可知,反应物总能量小于生成物的总能量,为吸热反应,破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,吸热反应,不一定需要加热,以此解答该题.
解答 解:A.由图可知,M和N的总能量大于X和Y的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,故A错误;
B.吸热反应不一定在加热的条件下发生,比如氯化铵和十水合氢氧化钡的反应就是吸热反应,但是不需加热条件就能发生,故B错误;
C.由图可知,生成物的总能量大于反应物的总能量,该反应为吸热反应,所以破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C错误;
D.由图象可知,反应物总能量小于生成物的总能量,则X和Y的总能量一定低于M和N的总能量,故D正确.
故选D.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、反应热与键能的关系为解答的关键,侧重分析与应用能力的考查,注意图象的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
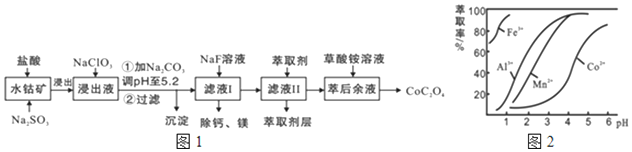
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
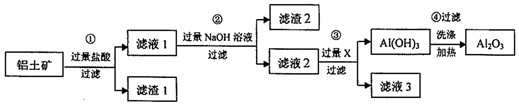
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用消毒酒精的体积分数为95% | |
| B. | 常用福尔马林溶液保存动物标本 | |
| C. | 医院常用银氨溶液检验病人的尿糖 | |
| D. | 工业上常用乙烷和氯气反应制取氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com