
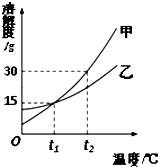
 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 将甲的饱和溶液变为不饱和溶液可采用降温的方法 | |
| C. | t1℃时,甲、乙的饱和溶液中溶质的质量分数不一定相等 | |
| D. | t2℃时,将甲、乙等质量的饱和溶液降温至t1℃,甲析出的固体一定大于乙 |
分析 A.根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小,利用图示的曲线,比较温度小于t1℃时和大于t1℃甲、乙两物质的溶解度大小;
B.甲的溶解度随温度的升高而升高,降温析出溶质后仍为饱和溶液;
C.根据溶解度曲线横、纵坐标分别表示的意义分析,溶解度曲线的交点,表示该温度下,两种物质的溶解度相同,根据饱和溶液中溶质的质量分数关系分析;
D.甲乙两溶液的溶质溶解度都是随着温度的增大而增大,甲的溶解度受温度的影响较大,t2℃时,甲的溶解度大于乙,t1℃,甲乙两溶液的溶解度相同,从t2℃时,将甲、乙等质量的饱和溶液降温至t1℃,甲析出的固体一定大于乙.
解答 解:A.利用图示的曲线,温度小于t1℃时甲的溶解度小于乙物质的溶解度,大于t1℃时,甲的溶解度大于乙物质的溶解度,故A错误;
B.将甲的饱和溶液采用降温,将析出甲溶质,析出溶质后仍为饱和溶液,将甲的饱和溶液变为不饱和溶液可采用升高温度的方法,故B错误;
C.饱和溶液,溶解度与溶质的质量分数A%=$\frac{S}{100+S}$×100%,t1℃时,甲、乙的饱和溶液溶解度曲线的交点,表示该温度下,两种物质的溶解度相同,则溶质的质量分数相同,故C错误;
D.t2℃时,甲、乙两种物质溶质溶解度甲>乙;即100克溶剂中溶解甲的质量大于乙的质量,在t1℃甲乙的溶解度相同,即100克溶剂中溶解甲的质量等于乙的质量,甲乙两溶液的溶质溶解度都是随着温度的增大而增大,当降温到t1℃,两者都有晶体析出,析出晶体后,甲乙两溶液仍为饱和溶液,此时100克溶剂中溶解甲溶质的质量等于乙的质量,t2℃时,100克溶剂中溶解甲的质量大于乙的质量,降温到t1℃,100克溶剂中溶解甲溶质的质量等于于乙溶质的质量,显然,甲析出的固体一定大于乙,故D正确;
故选D.
点评 本题考查溶解度曲线的应用,明确溶解度由线的意义是解答本题关关键,交点表示某温度下溶解度相等,同温下,饱和溶液的溶质质量分数与溶解度成正比,溶解度越大,饱和溶液的溶质质量分数越大,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜片消耗完所需时间 | |
| B. | 反应中氧化剂得到电子总数 | |
| C. | 反应后溶液中铜离子浓度(反应后溶液体积不变) | |
| D. | 反应生成气体的体积(同温、同压) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
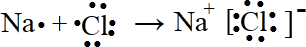 .
.| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
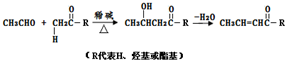
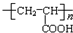 +HOCH2CH2OH$→_{△}^{浓硫酸}$
+HOCH2CH2OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. +NaOH→
+NaOH→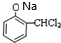 +H2O.
+H2O.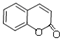 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 气态氢化物的还原性:X>Y、M>R | B. | 原子半径:Z>M>R、M<X<Y | ||
| C. | M与Z的原子核外电子数相差16 | D. | Q的最高价氧化物一定能溶于强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com