
| A. | 若反应过程转移0.2mol电子,则生成0.1mol羰基硫 | |
| B. | CO和H2S的反应中,H2S作还原剂 | |
| C. | 羰基硫的化学式为COS,是一种共价化合物 | |
| D. | 1mol羰基硫完全燃烧,消耗1.5mol氧气 |
分析 常温下,在恒容密闭容器中,将CO和H2S按1:1混合加热可得到羰基硫和氢气,且反应前后压强不变,说明反应是个气体的物质的量不变的反应,根据质量守恒可知发生的化学方程式为CO+H2S=COS+H2,此反应转移2mol电子,H2S为氧化剂,被还原为氢气,CO为还原剂,故氧化为COS,据此分析.
解答 解:常温下,在恒容密闭容器中,将CO和H2S按1:1混合加热可得到羰基硫和氢气,且反应前后压强不变,说明反应是个气体的物质的量不变的反应,根据质量守恒可知发生的发生的化学方程式为CO+H2S=COS+H2.
A.有反应方程式可知,反应转移2mol电子生成1molCOS,故当反应过程转移0.2mol电子,同时生成0.1mol羰基硫,故A正确;
B.CO和H2S的反应中,H2S被还原为氢气作氧化剂,故B错误;
C.羰基硫的化学式为COS,全部由非金属元素构成,故为共价化合物,故C正确;
D.COS的燃烧反应为:2COS+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2SO2,可知1mol羰基硫完全燃烧,消耗1.5mol氧气,故D正确;
故选B.
点评 本题考查了根据题干信息写出化学方程式并对化学方程式转移电子数、氧化剂还原剂进行分析,难度不大,应注意的是在恒温恒容的容器中,压强不变则说明气体的物质的量不变.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电解饱和食盐水可制得单质Na | |
| B. | 工业上常用H2还原MgO制得单质Mg | |
| C. | 通过加热分解HgO可制得单质Hg | |
| D. | 用铝热法还原MnO2和Fe2O3,制得金属各1mol,消耗铝较少的是MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2S | B. | HgS | C. | HgCl2 | D. | AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;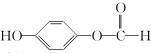 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com