
| A. | 埋在潮湿土壤里的铁管比在干燥土壤中的更易被腐蚀 | |
| B. | 在空气中,金属镁、铝的表面可形成一层氧化膜 | |
| C. | 为保护海轮的船壳,常在海轮上镶嵌锌块 | |
| D. | 镀锡的铁制品,镀层部分破坏后,露出的铁表面更容易被腐蚀 |
分析 A.金属的腐蚀分为电化学腐蚀和普通化学腐蚀,电化学腐蚀速率快与普通的化学腐蚀;
B.金属镁、铝易被氧气氧化;
C.Zn、Fe在一起易形成原电池;
D.根据原电池原理的应用:负极金属的腐蚀速率快于正极上的金属来解答.
解答 解:A.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀,与电化学腐蚀有关,故A不选;
B.金属镁、铝易被氧气氧化,在金属表面形成致密的氧化膜,与电化学腐蚀无关,故B选;
C.在船壳水线以下部分装上锌块,Zn、Fe在一起易形成原电池,Fe作正极被保护,属于牺牲阳极的阴极保护法,与电化学腐蚀有关,故C不选;
D.镀锡的铁制品,镀层部分受损后,形成原电池,因为铁的活泼性强于锡,铁做负极,发生氧化还原反应被腐蚀,与电化学腐蚀有关,故D不选;
故选B.
点评 本题考查了金属的腐蚀与防护,注意电化学腐蚀形成条件和知识的归纳综合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 | |
| D. | c2d2中各原子的最外层均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
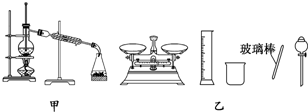
| A. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | CH3COOH | C. | NaCl(固体) | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |  |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 方 案 | 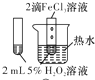 | 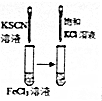 | 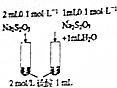 | 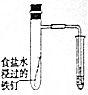 |
| 目 的 | A.验证升高温度可加快H2O2分解 | B.探究增大c(Cl-使平衡逆向移动 | C.探究浓度对化学反应速率的影响 | D.验证铁发生析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com