解答:
解:A、D、E、I是中学化学常见的单质,在通常状况下B也是常见的无色液体,结合反应特征分析可知B为H
2O,说明D和E为氧气和氢气,结合反应A+H
2O=D+C,分析判断推断D为H2,E为O
2,电解生成氧气的溶液K是不活泼金属的含氧酸盐,电解生成氧气,F为含氧酸,根据C+F=B+G+H,G可以和氧气反应生成H说明含有变价元素,F判断不是硝酸应硫酸,I是常见的金属单质推断为铜,确定K为CuSO
4,F为H
2SO
4,I为Cu,从而判断A为Fe,C为Fe
3O
4,G为FeSO
4,H为Fe
2(SO
4)
3,综上所述推断出的物质分别为:A为Fe,B为H
2O,C为Fe
3O
4,D为H
2,E为O
2,F为H
2SO
4,G为FeSO
4,H为Fe
2(SO
4)
3,K为CuSO
4,I为Cu;
(1)A-C是Fe→Fe
3O
4,发生化合反应生成四氧化三铁的反应为:3Fe+2O
2Fe
3O
4;
故答案为:3Fe+2O
2Fe
3O
4;
(2)G→H反应为硫酸亚铁和氧气酸性溶液中反应生成硫酸铁和水,反应的离子方程式为:4Fe
2++O
2+4H
+=4Fe
3++2H
2O;
故答案为:4Fe
2++O
2+4H
+=4Fe
3++2H
2O;
(3)在C与F反应生成G与H的混合溶液中,其中H中阳离子为Fe3+,依据铁离子的检验方法可知,取少量该溶液于小试管中,加入2至3滴KSCN溶液,溶液中出现红色,则存在Fe
3+;
故答案为:取少量该溶液于小试管中,加入2至3滴KSCN溶液,溶液中出现红色,则存在Fe
3+;
(4)用惰性电极电解200mL K溶液为CuSO
4溶液,一定时间后,在阴阳两极均收集到224mL(标况)气体,物质的量为0.01mol;阳极电极反应:4OH--4e
-=2H2O+O
2↑;
阴极电极反应:Cu
2++2e
-=Cu 2H
++2e
-=H
2↑
①电解硫酸铜溶液,阳极是溶液中氢氧根离子失电子生成氧气,电极反应为:2H
2O-4e
-=4H
++O
2↑,或4OH
--4e
-=2H
2O+O
2↑;
故答案为:2H
2O-4e
-=4H
++O
2↑,或4OH
--4e
-=2H
2O+O
2↑;
②电路中转移的电子的物质的量,依据依据电极反应计算得到,电极上生成0.01mol氧气,4OH
--4e
-=2H
2O+O
2↑,反应过程中转移电子0.04mol;
故答案为:0.04mol;
③依据电解过程中电子守恒,转移电子数为0.04mol,阴极电极反应:Cu
2++2e
-=Cu,2H
++2e
-=H
2↑,铜离子全部反应得到电子0.02mol,原溶液中 铜离子物质的量为0.01mol,原CuSO
4溶液的物质的量浓度=
=0.05mol/L;
故答案为:0.05mol/L;
④上述分析计算可知,电解过程是电解硫酸铜后,继续电解水,电解硫酸铜0.01mol,生成硫酸0.01mol,电解水共计0.02mol,要将上述电解后的溶液完全恢复到电解前,可向电解后的溶液中加入某纯净物,和硫酸反应生成的离子需要提供0.01mol铜离子,生成0.02mol水,该纯净物的化学式是Cu(OH)
2,此时依据水的电离平衡中氢离子和氢氧根离子守恒计算,得到溶液中增加的氢离子物质的量为0.04mol-0.02mol=0.02mol,c(H+)=
=0.1mol/L
PH=1;
故答案为:Cu(OH)2,1;




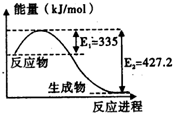 (1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol