
| A. | NaOH+CH3COOH | B. | BaCl2+CuSO4 | C. | AgNO3+NaCl | D. | Na2SO4+NaOH |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
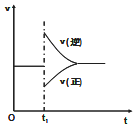 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:| A. | 保持压强不变,升高反应温度 | |
| B. | 保持温度不变,增大容器体积 | |
| C. | 保持温度和容器体积不变,充入1 mol C(g) | |
| D. | 保持温度和压强不变,充入1 mol C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
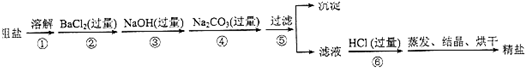
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH:NaF>NaCN | B. | n1>n2 | ||
| C. | H2O的电离程度:NaF>NaCN | D. | c(F-)<c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
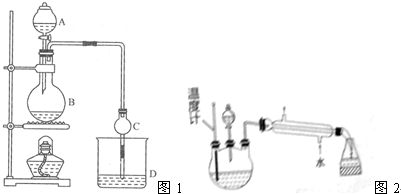
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com