
| A. | 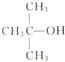 、CH3OH和浓硫酸共热 、CH3OH和浓硫酸共热 | B. | 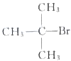 和CH3ONa共热 和CH3ONa共热 | ||
| C. | CH3Br和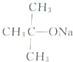 共热 共热 | D. |  和CH3OH在Al2O3存在下共热 和CH3OH在Al2O3存在下共热 |
分析 A. 在浓硫酸存在条件下加热容易发生副反应生成烯烃;
在浓硫酸存在条件下加热容易发生副反应生成烯烃;
B. 和CH3ONa共热,反应程度较小;
和CH3ONa共热,反应程度较小;
C.CH3Br和 共热,该反应不易发生;
共热,该反应不易发生;
D. 和CH3OH在Al2O3存在下共热可生成甲基叔丁基醚.
和CH3OH在Al2O3存在下共热可生成甲基叔丁基醚.
解答 解:A. 在浓硫酸存在条件下加热容易发生副反应生成烯烃,所以不是最佳合成路线,故A错误;
在浓硫酸存在条件下加热容易发生副反应生成烯烃,所以不是最佳合成路线,故A错误;
B. 和CH3ONa共热,反应程度减小,不是最佳合成路线,故B错误;
和CH3ONa共热,反应程度减小,不是最佳合成路线,故B错误;
C.CH3Br和 共热,反应程度减小,不是最佳合成路线,故C错误;
共热,反应程度减小,不是最佳合成路线,故C错误;
D. 和CH3OH在Al2O3存在下共热可以生成甲基叔丁基醚,该原理为最佳合成路线,故D正确;
和CH3OH在Al2O3存在下共热可以生成甲基叔丁基醚,该原理为最佳合成路线,故D正确;
故选D.
点评 本题考查了有机反应的综合应用,题目难度不大,明确常见有机物结构与性质为解答关键,注意掌握常见有机反应类型及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
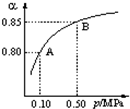
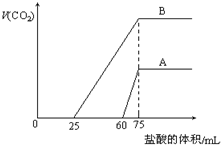 取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.
B.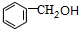 C.
C. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com