
| 数据 编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 由表中数据可估算出HX的电离常数Ka(HX)≈10-5 | |
| B. | 向上述实验③HX反应后的溶液中加入实验①中的HY溶液前后,水的电离程度增大 | |
| C. | 表中x<7,y=7 | |
| D. | 上述向HX中加amLNaOH时,溶液中c(Na+)=c(X-) |
分析 0.1000mol•L-1的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸.
A.0.100mol/L的HX溶液的pH=3,则c(H+)≈c(X-)=10-3mol/L,c(HX)=0.1mol/L-c(X-)≈0.1mol/L,再根据Ka(HX)=$\frac{c({H}^{+})×c({X}^{-})}{c(HX)}$计算;
B.实验③中HX恰好与NaOH反应,溶液中X-离子水解而呈碱性,再加入强酸HY溶液,抑制水的电离;
C.实验②中HX与NaOH恰好反应时得到NaX溶液呈碱性,反应后溶液中pH=7,则HX应少过量,即加入的NaOH溶液体积小于20.00mL,则HY与氢氧化钠反应后酸有剩余;实验③中HY与NaOH恰好反应生成NaY为强酸强碱盐,
D.结合电荷守恒与溶液pH=7判断.
解答 解:0.1000mol•L-1的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸.
A.0.100mol/L的HX溶液的pH=3,则c(H+)≈c(X-)=10-3mol/L,c(HX)=0.1mol/L-c(X-)≈0.1mol/L,则Ka(HX)=$\frac{c({H}^{+})×c({X}^{-})}{c(HX)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,故A正确;
B.实验③中HX恰好与NaOH反应,溶液中X-离子水解而呈碱性,再加入强酸HY溶液,抑制水的电离,水的电离程度减小,故B错误;
C.实验②中HX与NaOH恰好反应时得到NaX溶液呈碱性,反应后溶液中pH=7,则HX应少过量,即加入的NaOH溶液体积小于20.00mL,则HY与氢氧化钠反应后酸有剩余,溶液呈酸性,则x<7,;实验③中HY与NaOH恰好反应生成NaY为强酸强碱盐,溶液呈正向,则y=7,故C正确;
D.c(H+)=c(X-)+c(Y-)+c(OH-),上述向HX中加amLNaOH时,溶液pH=7,则c(H+)=c(OH-),结合电荷守恒c(H+)+c(Na+)=c(X-)+c(OH-),可知溶液中c(Na+)=c(X-),故D正确.
故选:B.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,根据表中数据判断HX、HY的酸性强弱为解答关键,注意掌握电荷守恒、物料守恒的含义及在判断离子浓度大小中的应用,明确酸碱混合的定性判断方法及溶液pH的计算方法.


科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. 、
、 、
、 、
、 任意1种.
任意1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 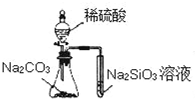 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 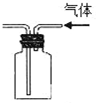 实验装置排空气法收集CO2气体 | |
| C. | 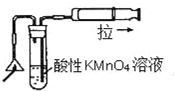 可以检验火柴燃烧生成的SO2气体 | |
| D. | 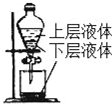 提取海带中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
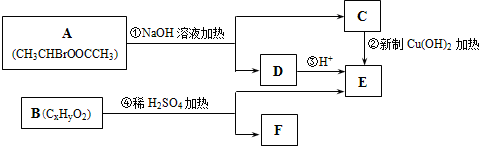
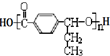
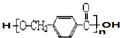 其合成路线如下:
其合成路线如下: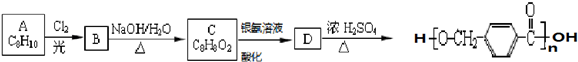
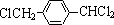 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.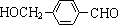 +2Ag(NH3)2OH $\stackrel{△}{→}$
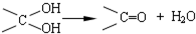
+2Ag(NH3)2OH $\stackrel{△}{→}$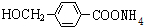 +2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n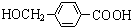 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$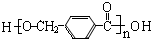 +(n-1)H2O.
+(n-1)H2O.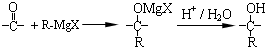
 ,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com