
| A、加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B、CuSO4?5H2O和Al2(SO4)3?18H2O均属于混合物 |
| C、实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D、高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
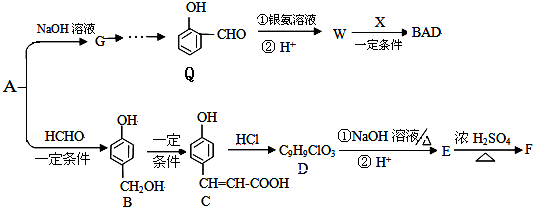
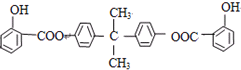
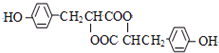
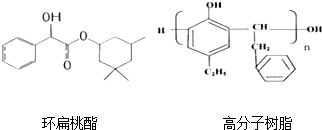
 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式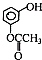
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
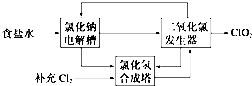
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com