
| A.CS2为V形的极性分子 |
B.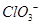 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和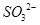 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
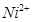 和
和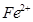 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);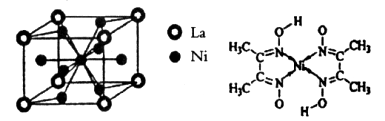
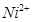 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与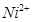 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。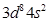 (2)> (3)6,6
(2)> (3)6,6 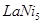 (5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分)
(5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分)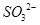 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。
的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。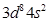 。
。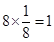 。镍原子数=
。镍原子数=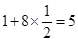 ,所以化学式为LaNi5。
,所以化学式为LaNi5。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.32 | B.120 | C.150 | D.180 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2+的半径小于N3-的半径 |
| B.H2O比H2S稳定是因为H2O中存在分子间氢键 |
| C.SiO2因的相对分子质量大于CO2,所以SiO2的熔点高于CO2 |
| D.由原子构成的晶体一定是原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920 ℃ | 97.8 ℃ | 1291 ℃ | 190 ℃ | 2073 ℃ | -107 ℃ | -57 ℃ | 1723 ℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①和④ | B.②和③ | C.①和③ | D.②和④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
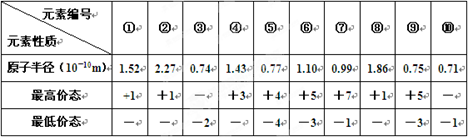
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com