
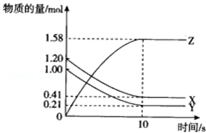
 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
分析 A、根据图可知,10s时X的物质的量减少了1.20mol-0.41mol=0.79mol,容器的体积为10L;
B、根据反应中反应物减小,生成物增加,变化的物质的量之比等于化学计量数之比,确定化学方程式;
C、根据图可知,反应开始到10s时,已用去的Y为1.0mol-0.21mol=0.79mol,占起始量为1mol;
D、根据反应平衡时各物质的物质的量不再随时间的变化而变化作判断.
解答 解:A、根据图可知,10s时X的物质的量减少了1.20mol-0.41mol=0.79mol,容器的体积为10L,X的物质的量浓度减少了0.079mol•L-1,故A错误;
B、根据图可知,X、Y物质的量都减小0.79mol,所以X、Y是反应物,Z增加了1.58mol,所以Z是生成物,X、Y、Z的变化的物质的量之比为1:1:2,所以化学方程式为X(g)+Y(g)═2Z(g),故B错误;
C、根据图可知,反应开始到10s时,已用去的Y为1.0mol-0.21mol=0.79mol,起始量为1mol,所以已用去的Y占起始量的百分比为79%,故C错误;
D、根据图可知反应进行到10s时各物质的物质的量不再随时间的变化而变化,此时反应处于平衡状态,故D正确;
故选D.
点评 本题主要考查了根据图象判断物质的变化量,利用物质的量变化量之比等于化学计量数之比写方程式等知识,难度不大,解题目关键在于注意图中的有关物理量.


科目:高中化学 来源: 题型:选择题
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只被氧化 | B. | 被氧化与被还原的个数比为1:3 | ||
| C. | 只被还原 | D. | 氧化剂与还原剂的质量比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
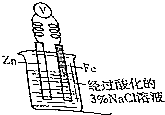 钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com