
����Ŀ����ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
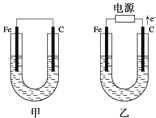
��1���������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�___�����ҳ��е�___����
���ҳ��������ĵ缫��Ӧʽ��___��
��2���������е������Һ��Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ___��
�ڼ׳���̼���ϵ缫��Ӧʽ��___���ҳ�̼���ϵ缫��Ӧ����___���������Ӧ����ԭ��Ӧ������
�۽�ʪ���KI������ֽ�����ҳ�̼��������������ֽ��������Ӧ�Ļ�ѧ����ʽΪ___��
�����ҳ�ת��0.02mole����ֹͣʵ�飬���е������Һ�����200mL������Һ��Ͼ��Ⱥ��pH��___��
���𰸡�̼ �� 4OH����4e����O2��+2H2O 2Cl��+2H2O![]() Cl2��+H2��+2OH�� 2H2O+O2+4e���T4OH�� ������Ӧ 2KI+Cl2��I2+2KCl 13
Cl2��+H2��+2OH�� 2H2O+O2+4e���T4OH�� ������Ӧ 2KI+Cl2��I2+2KCl 13
��������
��1���ټ׳�Ϊԭ��أ�ԭ����л��ý���������������������Ӧ��̼������������Cu�������ҳ�Ϊ���أ����·���������Դ����������̼��Ϊ�������ų��������������缫�Ϸ�����ԭ��Ӧ��Cu�������ʴ�Ϊ��̼������
����Ϊ���أ��ɵ��������֪��FeΪ������ͭ���ӵõ���������Cu���������������������ӷŵ磬�缫��ӦΪ4OH����4e����O2��+2H2O���ʴ�Ϊ��4OH����4e����O2��+2H2O��
��2�������������ҺΪ�����Ȼ�����Һ�����ҳؾ����ö��Ե缫Ϊ��������Ȼ�����Һ������ʽΪ��2Cl��+2H2O![]() Cl2��+H2��+2OH�����ʴ�Ϊ��2Cl��+2H2O
Cl2��+H2��+2OH�����ʴ�Ϊ��2Cl��+2H2O![]() Cl2��+H2��+2OH����
Cl2��+H2��+2OH����
�ڼ׳���̼��Ϊ�����������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H2O+O2+4e���T4OH�����ҳ���̼��Ϊ��������������������Ӧ���ʴ�Ϊ��2H2O+O2+4e���T4OH����������Ӧ��
�۽�ʪ���KI������ֽ�����ҳ�ʯī�缫������������ֽ��������ʯī�缫��������ʧ�������������������͵����ӷ�Ӧ���ɵⵥ�ʣ�����������Һ����ɫ����Ӧ����ʽΪ��2KI+Cl2��I2+2KCl���ʴ�Ϊ��2KI+Cl2��I2+2KCl��
�ܵ���Ȼ�����Һ�ķ���ʽΪ��2NaCl+2H2O![]() Cl2��+H2��+2NaOH���ҳ�ת��0.02mole��������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c��
Cl2��+H2��+2NaOH���ҳ�ת��0.02mole��������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c��![]() ��
��![]() ��0.1mol/L��������Һ��������Ũ�ȣ�
��0.1mol/L��������Һ��������Ũ�ȣ�![]() ��������Һ��pH��13���ʴ�Ϊ��13��
��������Һ��pH��13���ʴ�Ϊ��13��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ����H3A�ڱ�����Լ���ϴ�Ӽ������ȷ��������Ҫ�ĵ�λ������ʱ����10mL0.01mol��L-1��H3A��Һ�е���0.01mol��L-1��NaOH��Һ��H3A��H2A-��HA2-��A3-�����ʵ�����������Һ��pH�Ĺ�ϵ��ͼ��ʾ��������˵���д�����ǣ� ��

A.����ʱ��0.01mol��L-1��H3A��Һ��pH����2��3֮��
B.����ʱ����ӦA3-+H2O ![]() HA2-��OH-��ƽ�ⳣ��ΪK=10c-14
HA2-��OH-��ƽ�ⳣ��ΪK=10c-14
C.��b=7�������ʵ�����NaH2A��Na2HA���뵽��������ˮ��ʹ����ȫ�ܽ⣬�����õ���Һ��pHһ������7
D.����NaOH��Һ�����Ϊ30mLʱ��������Һ�д����У�c(OH-)=3c(H3A)��2c(H2A-)��c(HA2-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(KBe2BO3F2)�Ǽ������ĺ��IJ��ϣ��ҹ���ѧ���ڴ�������о��������������ǰ�С��ش���������:
(1)����������и�Ԫ��ԭ�ӵĵ�һ�����ܴ�С˳����F>O>______________����̬K������ռ������ܼ��ĵ���������ͼΪ_____________�Ρ�
(2) NaBH4���л��ϳ��г��õĻ�ԭ�������������ӵļ���Ϊ___________��
(3)������ԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ___________��___________(����ĸ���)��
A.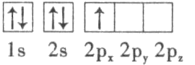 B.
B.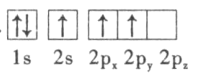
C. D.
D.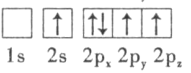
(4)��Ԫ�صļ��⻯��BH3����������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
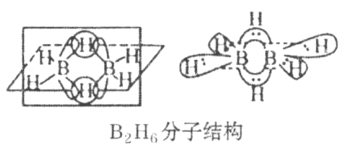
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ_________��
��������(NH3BH3)����Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����_______________��д��һ���백���黥Ϊ�ȵ�����ķ���________________(�ѧʽ)��
(5)����(BP)���ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ������ṹ��ͼ��ʾ��P����λ��Ϊ_____________��������z����ƽ���ͶӰͼ�У�Bԭ�ӹ��ɵļ�����״��_______________����֪�����߳�Ϊapm������������ܶ���___________g��cm��3��
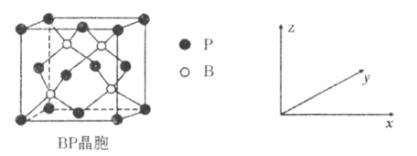
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������������������100 mL 1.7mol/L��NaOH��Һ��ȫ���ա������պ����Һ���з������飬��֪c(OH-)=0.1mol/L (�����Ƿ�Ӧǰ����Һ������仯) ��ClO����ClO3�������ʵ���Ũ��֮��Ϊ5��1����ش�
��1�������������ĵ�NaOH�����ʵ���Ϊ_______________mol��
��2�������������������ʵ���Ϊ_______________mol������ԭ�����������ʵ���Ϊ _______________mol��
��3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ�β���е����������ĵĶ������̵�����Ϊ_______________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��
��![]() ��
��![]() ������ԭ��������������Ķ�����Ԫ�ء��ס��ҡ����ֱ�������Ԫ���γɵĵ��ʣ�
������ԭ��������������Ķ�����Ԫ�ء��ס��ҡ����ֱ�������Ԫ���γɵĵ��ʣ�![]() ��
��![]() ��
��![]() ��
��![]() �ֱ�����
�ֱ�����![]() ��
��![]() ��
��![]() �γɵĶ�Ԫ�������
�γɵĶ�Ԫ�������![]() ��
��![]() �����о�����10�����ӡ�����֮��ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ����
�����о�����10�����ӡ�����֮��ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ����
A.ԭ�Ӱ뾶��![]()
B.![]() ��
��![]() �γɵĻ�����ֻ�����Լ�
�γɵĻ�����ֻ�����Լ�
C.![]() �ж���ͬ�������壬�Ҿ����и��۵㡢�߷е㡢Ӳ�ȴ������
�ж���ͬ�������壬�Ҿ����и��۵㡢�߷е㡢Ӳ�ȴ������
D.�ȶ��ԣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�U����Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ��ʳ��ˮ�����ᣬ�����������飬����һ��ʱ�䡣�����й��������� ��
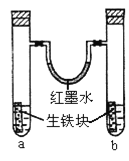
A.�������е�̼��ԭ��ص�����
B.��īˮ�����ߵ�Һ���Ϊ����ҵ�
C.���Թ�����ͬ�ĵ缫��Ӧʽ�ǣ�Fe-3e-=Fe3+
D.a�Թ��з�����������ʴ��b�Թܷ��������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ૼ����׳ƿ��ᣬ�㷺Ӧ�������Ϲ�ҵ��ʳƷ��ҵ��Ϳ�ϡ�ҽҩ�����ϵȡ���ૼ�ȩ�Ʊ�ૼ������Ʒૼ״���ԭ��Ϊ��
��Ӧ1��![]() +NaOH
+NaOH![]()
![]() ��H��0
��H��0
��Ӧ2��![]() +HCl
+HCl![]()
![]() +HCl
+HCl
ij�о���ѧϰС��������ͼװ���Ʊ�ૼ����ʵ���������£�
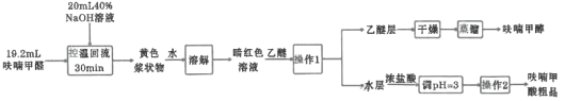
��֪�������ѣ�![]() ���е�34.6�����������ж�����ʹ��ʧȥ֪����
���е�34.6�����������ж�����ʹ��ʧȥ֪����
����Ҫ�Լ���������������£�
�Լ� | ��Է������� | �ܶ�/ | �۵�/�� | �е�/�� | �ܽ��� |
ૼ�ȩ | 96 | 1.16 |
| 161.7 | ����ˮ���������Ҵ������ѡ� |
ૼ״� | 98 | 1.13 |
| 171.0 | ����ˮ���ɻ������Ҵ������ѡ� |
ૼ��� | 112 | - | 129.5 | 231.0 | ������ˮ������ˮ���ܽ�Ƚϴ��������Ҵ������ѡ� |
��ش��������⣺
��1�������»�����ʱ����Ʒ�Ӧ�¶�8~12����Ӧ��ȡ�Ŀ��·�ʽ��________��������ƿ���������![]() ��ҺӦ���Ԥ����________���μ�ૼ�ȩʱ��________��
��ҺӦ���Ԥ����________���μ�ૼ�ȩʱ��________��
��2���������»�����ʱ��ֽ�����ܻ�ýϸ߲��ʡ���ԭ����________��
��3��������1��������Ϊ________�����õ��IJ���������Ҫ��________��������2����Ҫ����________��________��
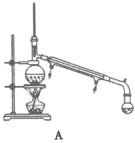
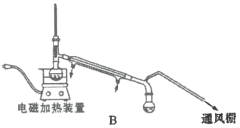
��4����������ʱ������ͼ________������ĸ��ţ�װ�ø��ã�����һװ����ȣ���װ�õ��ŵ��Т�________����________��
��5��ૼ����Ʒ���������õķ�����________�����յõ�����Ʒ9.86g��ૼ���IJ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ��������ƽ�в���ʢ��һ��Ũ�ȵ�NaOH��Һ���ձ��У��õ��ߺ͵��������ӳ�ԭ��أ�װ����ͼ��ʾ���˵�ع���ʱ������������ȷ����( )

A. Mg��Al���ã�Mgʧȥ���ӱ�������Mg2+
B. ����������������Ĥ�����ɲ��ش���
C. �õ�ص������·�У����������ɵ��Ӷ����ƶ��γɵ�
D. Al�ǵ�ظ�������ʼ����ʱ��Һ�л������а�ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪������298Kʱ���Ȼ�ѧ����ʽ��2H2(g)+O2(g)=2H2O(l) ��H=-571.6 kJ��mol-1��CH4(g)+2O2(g)=CO2(g)+2H2O (l) ��H=-890.3 kJ��mol-1��C(s)+O2(g)=CO2(g) ��H=-393.5kJ��mol-1������������Ȼ�ѧ����ʽ����������⣺
��1��ͨ������˵����������H2��C��CH4��ȫȼ��ʱ�ų�����������___��
��2���������Ϸ�Ӧ����C(s)+2H2(g)=CH4(g)���ʱ䦤H=___��
��3����֪H2O(l)=H2O(g) ��H=+44.0kJ��mol-1
��д������ȼ�����ɶ�����̼��ˮ�������Ȼ�ѧ����ʽ��___��
��Ϊ�˽������ʴ��ԭ���Ѱ���ֹ������ʴ�ķ���������Ҫ���塣
��1���ֱ��������װ�ã���ʢ��0.1mol��L-1��H2SO4��Һ���е��Ŀ���ͬ�Ĵ�пƬ�����и�ʴ������___��
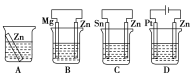
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ����������XΪ̼����Ϊ�������ĸ�ʴ������KӦ����___������XΪп������K����M�����õ绯ѧ��������Ϊ___��
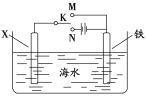
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com