
分析 设A、B的起始浓度为x、y,则
A(g)+B(g)?2C(g)
开始 x y 0
转化 0.25 0.25 0.5
2min 0.5 0.75 0.5
结合开始的量=转化的量+剩余的量计算.
解答 解:设A、B的起始浓度为x、y,则
A(g)+B(g)?2C(g)
开始 x y 0
转化 0.25 0.25 0.5
2min 0.5 0.75 0.5
A的起始浓度x=0.25mol+0.5mol=0.75 mol/L,B的起始浓度y=0.25mol+0.75mol=1.0 mol/L,
则A起始的物质的量为0.75 mol/L×2 L=1.5 mol,B起始的物质的量为1.0 mol/L×2 L=2.0 mol,
故答案为:1.5;2.0.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应中量的关系为解答的关键,侧重分析与计算能力的考查,注意三段法应用,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
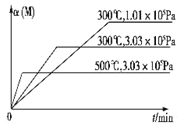 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )| A. | x=2 | |
| B. | 平衡时,v 正 (B):v 逆 (C)=2:3 | |
| C. | 若保持容器容积不变,充入N,则C的物质的量减小 | |
| D. | 若保持容器容积不变,充入Q,反应①的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该容器中加入少量A,反应速率增大 | |
| B. | 向该容器中充入氩气,反应速率增大 | |
| C. | 将粉末状A代替块状A能加快反应 | |
| D. | 该反应为放热反应,无需加热即可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作及现象 |
| A | 检验1-溴丙烷中含有溴 | 将1-溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,得沉淀 |
| B | 验证样品中一定含有苯酚 | 向样品溶液中滴加氯化铁溶液后显紫色 |
| C | 验证蔗糖没有水解 | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀 |
| D | 证明蛋白质的变性是不可逆的 | 向蛋白质溶液中滴加CuSO4溶液,有固体析出,过滤,向固体中加足量水,固体不溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com