
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.使pH试纸显蓝色的溶液中:Cu2+、NO![]() 、Fe3+、SO
、Fe3+、SO![]()
B.与铝粉反应放出氢气的无色溶液中:NO![]() 、Al3+、Na+、SO
、Al3+、Na+、SO![]()
C.pH=0的溶液中:Al3+、NH![]() 、Ca2+、ClO-
、Ca2+、ClO-
D.使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断不正确的是
![]()
A. 最高正化合价:X<Y<Z
B. 原子半径:X<Y<Z
C. 气态氢化物的热稳定性:Z<W
D. 最高价氧化物对应水化物的酸性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是

A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
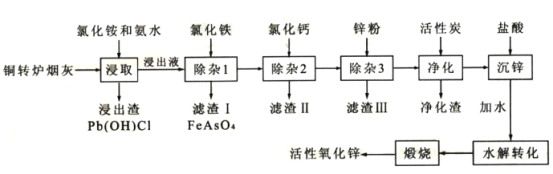
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
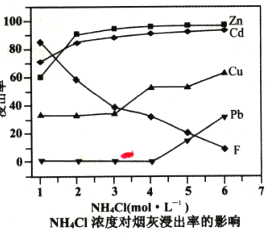
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下,则下列说法不正确的是

A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.SiF4和 CO![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
B.![]() 此图错误,违背了泡利原理
此图错误,违背了泡利原理
C.凡中心原子采取sp3 杂化的分子,其 VSEPR 模型都是四面体
D.SO2为 V 形的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遵义市某些地区出现了不同程度的雾霾天气,我校课题小组的同学对其进行了调查研究,
Ⅰ.课题小组研究发现,其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
(1)25℃时将PM2.5样本用蒸馏水处理制成待测溶液。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断试样的pH=________。
Ⅱ.课题组就其酸性物质做进一步研究
一氧化氮、二氧化氮的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:
2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)活性炭可处理大气污染物NO,反应原理为:C(s)+2NO(g)![]() N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
III.一氧化碳、二氧化碳的研究
(1)CO或CO2在一定条件下可以用来合成甲醇。工业上常用CO和H2制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。

(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
①计算反应Ⅳ:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______kJ/mol;
CaCO3(s)+2H2(g)的△H=______kJ/mol;
对硫的氧化物的研究
②SO2可被Na2FeO4氧化而去除污染,工业上用Fe和石墨作电极电解浓NaOH溶液制备Na2FeO4。写出电解过程中阳极发生的电极反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的___极连接,电极反应式为__________。
②放电时生成Ni(OH)2的一极,在充电时发生_______反应(填“氧化”或“还原”)
(2)按如图所示装置进行下列不同的操作

①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为__________________________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。 下列说法正确的是

A.溶解度S(FeS)<S(ZnS)
B.a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2﹣)
C.向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液
D.向含有Fe2+和Zn2+的溶液中滴加Na2S溶液,FeS先析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com