
分析 根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标目标热化学方程式,反应热也乘以相应的系数,进行相应的加减,据此计算,
(1)已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g )△H2=32.4kJ•mol-1
根据盖斯定律,①-②得;
(2)①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol-1
由盖斯定律①-②得到.
解答 解:(1)已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g )△H2=32.4kJ•mol-1
根据盖斯定律,①-②得C3H8(g)═CH3CH=CH2(g)+H2(g),所以△H=△H1-△H2=156.6kJ•mol-1-32.4kJ•mol-1=+124.2kJ•mol-1,热化学方程式为:C3H8(g)═CH3CH=CH2(g)+H2(g)△H=+124.2kJ•mol-1,
故答案为:C3H8(g)═CH3CH=CH2(g)+H2(g)△H=+124.2kJ•mol-1;
(2)①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol-1
由盖斯定律①-②得到:Na2CO3•H2O(s)═Na2CO3(s)+H2O(g)△H=+58.73kJ•mol-1,
故答案为:Na2CO3•H2O(s)═Na2CO3(s)+H2O(g)△H=+58.73kJ•mol-1.
点评 本题考查反应热的计算,涉及盖斯定律的运用,注意目标热化学方程式的构建,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加压条件下有利于SO2和O2反应生成SO3 | |
| C. | 将NO2球浸泡在热水中颜色加深 | |
| D. | 加催化剂,使N2和H2在一定的条件下转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3COCH2CH3 | D. | 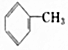 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
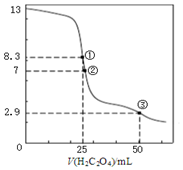 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
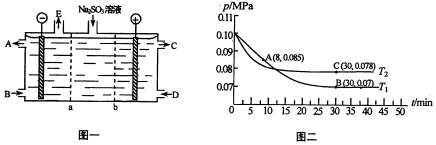
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
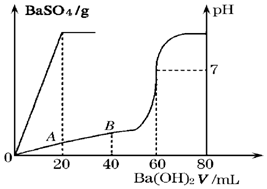 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com