
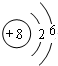 ,故答案为:
,故答案为: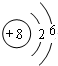 ;
;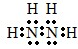 ,故答案为:
,故答案为: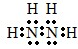 ;
;| 97.7% |
| 14 |
| 2.3 |
| 1 |
| 2.15g |
| 43g/mol |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
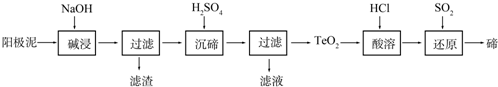
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别取样配成溶液,滴加CaCl2溶液,观察有无白色沉淀 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②③④ |
| C、①②③⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠受热易分解,可用于生产食品发酵粉 |
| B、次氯酸钠具有强氧化性,可用于配制消毒液 |
| C、二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸 |
| D、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、Cl-、HCO3- |
| B、Na+、Al3+、SO42-、OH- |
| C、Na+、NH4+、H+、Cl- |
| D、Fe3+、Ba2+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ | B、只有①③ |
| C、只有①④ | D、只有②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com