
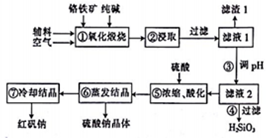
 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.分析 铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、Na2SiO3等,加入水浸取,得到滤渣1为Fe2O3,过滤得滤液1为Na2CrO4、Na2SiO3等,将滤液调节pH得到滤渣2为H2SiO3,过滤后将滤液酸化,发生了反应2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,生成了Na2Cr2O7和Na2SO4,蒸发结晶得到硫酸钠,冷却结晶得到Na2Cr2O7•2H2O,据此答题.
解答 解:铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、Na2SiO3等,加入水浸取,得到滤渣1为Fe2O3,过滤得滤液1为Na2CrO4、Na2SiO3等,将滤液调节pH得到滤渣2为H2SiO3,过滤后将滤液酸化,发生了反应2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,生成了Na2Cr2O7和Na2SO4,蒸发结晶得到硫酸钠,冷却结晶得到Na2Cr2O7•2H2O,
(1)铬铁矿在氧化煅烧前要先粉碎的主要目的是增大固体与硫酸的接触的表面积,加快铬铁矿的溶解速率,
故答案为:增大铬铁矿与硫酸的接触面积,加快铬铁矿的溶解;
(2)根据上面的分析可知,滤渣1的主要成分是 Fe2O3,滤液1的主要成分为Na2CrO4、Na2SiO3,
故答案为:Fe2O3;Na2CrO4、Na2SiO3;
(3)根据上面的分析可知,步骤③调pH的目的是使硅酸钠生成硅酸沉淀而除去,
故答案为:使硅酸钠生成硅酸沉淀而除去;
(4)步骤⑤中反应为酸性条件下,反应的离子方程式为 2CrO42-+2H+?Cr2O72-+H2O,由于Cr2O72-有强氧化性,能氧化盐酸,所以酸化时不能用盐酸代替硫酸,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;不能;Cr2O72-有强氧化性,能氧化盐酸;
(5)根据方程式Na2Cr2O7+2KCl═K2Cr2O7+2NaCl可知,29.8gNa2Cr2O7•2H2O理论上可生成K2Cr2O7的质量为$\frac{29.8}{298}×294$g=29.4g,所以K2CrO7的产率为$\frac{26.3g}{29.4g}$×100%=89.5%,
故答案为:89.5%.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 装置 图 | 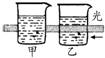 |  | 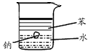 | 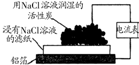 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com