
����Ŀ����ͼ��һ���绯ѧ���̵�ʾ��ͼ�� 
��ش��������⣺
��1��ͼ�м׳������ԭ��ء������ء���Ƴء�����
��2��A��ʯī���缫���������������������������������������������
��3��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ���ҳ���B��Ag������������5.4g���׳�������������O2�����ΪL����״��������ʱ������ij�缫����1.6gij������������е�ij����Һ������ A��MgSO4B��CuSO4 C��NaCl D��AgNO3 ��
���𰸡�
��1��ԭ���
��2������
��3��CH3OH+8OH����6e��=CO32��+6H2O
��4��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��0.28��BD
4Ag+O2��+4HNO3��0.28��BD
���������⣺��1���׳����Է��Ľ���������ԭ��Ӧ����������ԭ��أ����Դ��ǣ�ԭ��أ���2�����ǵ��أ���Ϊԭ��أ�ͨ��������������A������������Ϊ�����е����������Դ��ǣ���������3��ȼ�ϵ���У�������ͨ��ȼ�ϣ����������£��״�ˮ�к����������ӷ�Ӧ����̼������Ӻ�ˮ�����Ե缫��ӦʽΪ��CH3OH+8OH����6e��=CO32��+6H2O�� ���Դ��ǣ�CH3OH+8OH����6e��=CO32��+6H2O����4���ҳ��ǵ��أ�̼���������������������Է�Ӧ�ǵ����������Һ����ط�ӦʽΪ��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3 �� �ҳ��ǵ��أ�B���������ӵõ��ӷ�����ԭ��Ӧ��������������ת�Ƶ�����ȣ����ҳ���B������������5.4gʱ���׳�������������O2�����=
4Ag+O2��+4HNO3 �� �ҳ��ǵ��أ�B���������ӵõ��ӷ�����ԭ��Ӧ��������������ת�Ƶ�����ȣ����ҳ���B������������5.4gʱ���׳�������������O2�����= ![]() ��22.4L/mol=0.28L��
��22.4L/mol=0.28L��
�����ǵ��أ������Ͻ������ӷŵ������������ʣ������Ԫ������Ԫ��֮��D�缫���Ӽ״��缫������D������������ת�Ƶ������֪��������һ�۽���ʱ����Ħ������= ![]() =32g/mol�����������ȫ����ʱ������������������ת�Ƶ�������ȣ��������Ľ���Ħ����������32g/mol����D��ȷ��
=32g/mol�����������ȫ����ʱ������������������ת�Ƶ�������ȣ��������Ľ���Ħ����������32g/mol����D��ȷ��
���������Ƕ��۽�������![]() =64g/mol�����Ըý�����ͭ������Һ������ͭ��Һ����ѡBD��
=64g/mol�����Ըý�����ͭ������Һ������ͭ��Һ����ѡBD��
���Դ��ǣ�4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��0.28��BD��
4Ag+O2��+4HNO3��0.28��BD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڱ���1��36��֮���W��X��Y��Z��Q����Ԫ�أ����ǵ�ԭ����������������֪W����������Ԫ�ؼȲ�ͬ����Ҳ��ͬ���壬Xԭ�ӵ�L��p�������2�����ӣ�YԪ��ԭ�ӵ��������3������������ͬ��δ�ɶԵ��ӣ�ZԪ��ԭ�ӻ�̬ʱ����������Ų���3���ܼ��ϣ�����2��δ�ɶԵ��ӣ�QԪ���ڵ������ڣ�ԭ�ӵ�K�������������������֮��Ϊ2��1����d�������ȫ����״̬��
��1���������Ų���QԪ�������ڱ���������
��2����һ������YZ���縺��YZ�����������=����������
��3��W��Z�γɵij�����������W2Z��W2Z2 �� W��Y���γɶ��ֶ�Ԫ�������YW3��Y2W4��Y3W5��Y4W6����W2Z������Zԭ�ӵ��ӻ�����Ϊ �� YW3���ӵ����幹��Ϊ �� YW3��������W2Z����Ҫԭ���� ��
��4��������Q2+����������Һ�еμӹ�����ˮ���õ�����ɫ��Һ���ټ��Ҵ���������ɫ�����������þ����������к��еĻ�ѧ���� ��
��5��Q+��Y3���γɵľ����ṹ��ͼ��ʾ�����������Ӽ�ĺ˼��Ϊ a pm������٤��������NA ��ʾ��������ܶ�Ϊgcm��3 �� 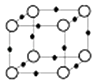
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��Դ��������ȷ����
A. ��ѧ��Դ�Ȼ�������Ի�ѧ�ܵ������ʸ�
B. ��ѧ��Դ���ṩ�ĵ��ܾ�����������ֽ��ܺĵ�������λ
C. ��ѧ��Դ���ǰ�ȫ������Ⱦ��
D. ��ѧ��Դ��Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����пƬ��1 mol��L��1ϡ���ᷴӦ��ȡ����ʱ�����д�ʩ����ʹ�������������������
A. �Ը÷�Ӧ��ϵ����
B. ��Ũ�������ϡ����
C. ����пƬ������п��
D. ��������1 mol��L��1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���CH3CH=CHCl�ɷ����ķ�Ӧ��
��ȡ����Ӧ���ڼӳɷ�Ӧ������ȥ��Ӧ����ʹ��ˮ��ɫ����ʹ���Ը��������Һ��ɫ������AgNO3��Һ��Ӧ�õ���ɫ�������߾ۺϷ�Ӧ����ȷ����(����)
A.���Ϸ�Ӧ���ɷ���
B.ֻ�Т߲��ܷ���
C.ֻ�Т��ܷ���
D.ֻ�Тڲ��ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ���ͬϵ���м�������KMnO4������Һ������ɫ����ȷ�Ľ���Ϊ (����)
A.����ͬϵ������е�̼ԭ�����ȱ������е�̼ԭ������
B.�����ܲ���Ӱ���ױ�����
C.�����ܱ���Ӱ���ױ�����
D.���ڱ����Ͳ������Ӱ����ױ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������к������Ҫ��SO2��H2S����ת���Ի�������������Ҫ���壮
��1��SO2�Ĵ����ŷŻ��������صĻ��������� �� ��ʪ�����£�д��������SO2ת��ΪHSO3���ķ���ʽ ��
��2�������е�����ɽ�������H2S��������Ӧ������SO42�� �� ������Ӧ�������仯ʾ��ͼ1���£�
1mol H2S��g��ȫ��������SO42����aq�����Ȼ�ѧ����ʽΪ
��3��SO2�ǹ�ҵ�������ԭ������֮һ��һ���¶��£����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2 �� ������Ӧ��2SO2��g��+O2��g��2SO3��g���������вⶨ�IJ������ݼ�����
ʱ��/min | n��SO2��/mol | n��O2��/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
�ٷ�Ӧ��0��4min�ڵ�ƽ������Ϊv��SO2��=��
�ڴ��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ��
��8minʱ��ά���¶Ȳ��䣬����Ӧ��������ͨ��0.020mol SO2��g����0.010mol O2��g�������´ﵽƽ��ʱ���������SO2�İٷֺ����������С�����������䡱������4����H2S �Ϳ����Ļ������ͨ��FeCl3��FeCl2��CuCl2�Ļ����Һ�з�Ӧ����S��������ת����ͼ2��ʾ��
�����¶�һ���Ͳ�������Һ�������£�����ͨ�������壬����ֽ��裮��ʹ���ɵ������в���CuS���ɲ�ȡ�Ĵ�ʩ�� ��
��һ����˵�����һ����Ӧ��ƽ�ⳣ������105 �� ͨ����Ϊ��Ӧ���еý���ȫ���෴�����һ����Ӧ��ƽ�ⳣ��С��10��5 �� ����Ϊ�����Ӧ���ѽ��У���֪�����¸����ʵ��ܶȻ�������ƽ�ⳣ����
CuS��Ksp=6.3��10��36��H2S��K a1=1.3��10��7 �� K a2=7.1��10��15 ��
ͨ������˵����ӦCuS��s��+2H+ ��aq��=Cu2+��aq��+H2S��aq�����еij̶� �� 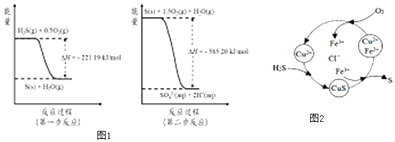
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ǿ��������ʵ���������ȷ����
A.ǿ���������Һ����ȫ���������������
B.ǿ�������Һ����������һ�������������Һ��������ǿ
C.ͬһ�������ͬŨ�ȵ���Һ���¶Ȳ�ͬʱ������������ͬ
D.ǿ�����������ˮ���������һ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ѡ���ȷ����(����)
A. ��֪A����H2B(����)= HA��HB������ˮ��������HB����A����B2��
B. ��0.1 mol/L��ˮ�еμ�0.1 mol/L���ᣬǡ����ȫ�к�ʱ��ҺpH=a������ˮ���������c(OH��)=10��a mol/L
C. ��Na2SO3��Һ���У� c��Na+��=2c��HSO3-��+2c��SO32-��+2c��H2SO3��
D. ����ȥCuCl2��Һ�л���������FeCl3���ɼ���CuO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com