
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水制取氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- |
分析 A.不符合反应客观事实;
B.二者反应生成氯化铵和氢氧化铝;
C.电荷不守恒;
D.二氧化硫少量,反应生成亚硫酸钠和水.
解答 解:A.铁和稀硫酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.氯化铝溶液中加入过量氨水制取氢氧化铝,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B正确;
C.用FeCl3溶液腐蚀印刷电路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.氢氧化钠溶液中通入少量二氧化硫气体,离子方程式:SO2+2OH-═H2O+SO32-,故D错误;
故选:B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
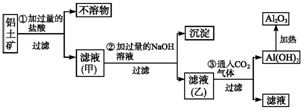 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 溴丙烷水解制丙醇与丙烯和水反应制丙醇属于不同反应类型 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ① | C. | ④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取80.0g晶体用于配制溶液 | |
| B. | 将正确称取的晶体置于预先量取的500mL水中 | |
| C. | 定容前先将烧杯中溶解得到的溶液小心地直接倾倒至500mL规格的容量瓶 | |
| D. | 正确定容后,再将容量瓶塞盖好,反复上下颠倒,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5mol•L-1 | B. | 4.5mol•L-1 | C. | 7.0mol•L-1 | D. | 9.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
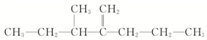 .
. 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯. 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷. 名称为:2,5-二甲基-2,4-己二烯.
名称为:2,5-二甲基-2,4-己二烯. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的c(H+)=1×10-3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com