
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
分析 A.碳酸钙为沉淀,应保留化学式;
B.不符合反应客观事实;
C.漏掉氢离子与氢氧根离子;
D.二者反应生成氯化亚铁和铜.
解答 解:A.碳酸钙与盐酸反应,离子方程式:CaCO3+2H+=H2O+CO2↑+Ca2+,故A错误;
B.稀 H2SO4与铁粉反应,离子方程式:Fe+2H+=Fe2++H2↑,故B错误;
C.氢氧化钡溶液与稀H2SO4 反应,离子方程式:Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,故C错误;
D.氯化铜溶液与铁粉反应,离子方程式:Cu2++Fe=Fe2++Cu,故D正确;
故答案为:D.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 取ag混合物充分加热,剩余bg固体 | |
| B. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg | |
| C. | 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 溶液中有K+ |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:2:4 | B. | 1:1:1:1 | C. | 2:1:1:2 | D. | 1:2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
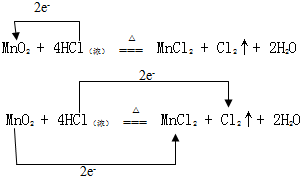 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯甲烷(CH3Cl) | B. | 甲基(-CH3 ) | C. | 碳负离子(CH3-) | D. | 乙烯(C2H4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com