
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济性要求的是 ( )
A.乙烯发生加聚反应制得聚乙烯高分子材料
B.用甲烷与氯气制备一氯甲烷
C.用苯和液溴为原料制取溴苯
D.用石灰石和稀盐酸反应制得二氧化碳
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式______________;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为n(H2SO4)∶n(HNO3)=__________。
(2)乙方案:将6.4 g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入40 mL 10%的H2O2,反应0.5 h,升温到60 ℃,持续反应1 h后,经一系列操作,得CuSO4·5H2O 20.0 g[已知有关摩尔质量:M(Cu)=64 g·mol-1,M(CuSO4·5H2O) =250 g·mol-1]。
①反应时温度控制在50~60 ℃,不宜过高的原因是______________;
②本实验CuSO4·5H2O的产率为______________。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶。
①物质A可选用以下的________(填序号);
A.CaO B.NaOH C.CuCO3
D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是______________;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):____________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的描 述中正确的是( )
述中正确的是( )
A.需 要加热才能发生的反应一定是吸热反应
要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀
溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)==2CO2(g)
ΔH=- 283.0 kJ·mol-1
283.0 kJ·mol-1
D.已知2C(s)+2O2(g)= ==2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则b>a
==2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
现以C8H18为原料经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,结合有关知识回答问题:
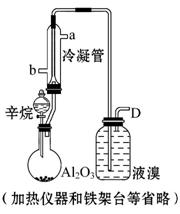
(1)生成乙烯的化学方程式为
,
。
(2)生成1,2-二溴乙烷的化学方程式是
。
(3)使用冷凝管的目的是 ,
冷凝管的进、出水方向为 。
(4)设计三种简单的实验证明广口瓶内发生的是加成反应而不是取代反应:
①第一种:
。
②第二种:
。
③第三种:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于裂化和裂解的叙述中,不正确的是 ( )
A.裂解与裂化的产物中都含有不饱和烃
B.裂解与裂化都是为了得到气态烃
C.裂解与裂化的原料都是石油分馏产品
D.裂解与裂化都是为了使相对分子质量大的烃断裂成相对分子质量小的烃
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有 (填代号)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是 。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.新制氯水
C.KMnO4溶液 D.H2O2
理由是 。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,pH = 11的稀氨水,下列判断正确的是
A.若升高温度,Kb、Kw均增大
B.用稀盐酸恰好中和时,溶液的pH=7
C.加水稀释,c(NH4+)·c(OH-)增大
D.加入pH = 11的NaOH溶液,NH3·H2O电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、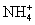 、Na+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、
、Na+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、 、
、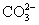 、
、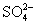 。将上述六种物质溶于水均配成0.1 mol·L-1的溶液,进行如下实验。
。将上述六种物质溶于水均配成0.1 mol·L-1的溶液,进行如下实验。
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C。
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失。
③向F中加入A有无色气体生成。
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气味的气体。
(1)根据以上信息,填写下列溶液中溶质的化学式。
C ,E 。
(2)D与过量的E反应的离子方程式为__________________________________。
(3)实验④中反应的离子方程式为__________。
(4)向100 mL A溶液中慢慢滴加入75 mL F溶液和向75 mL F溶液中慢慢滴加入100 mL A溶液产生的气体体积之比约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于高分子化合物的说法正确的是( )
A.合成高分子化合物的小分子就是高分子的链节
B.缩聚反应的产物只有高分子
C.聚乙烯具有热塑性
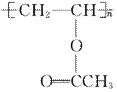 D.1 mol 水解后只能与1 mol NaOH反应
D.1 mol 水解后只能与1 mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com