
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-、HCO3-
B. 含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C. 常温下,![]() =1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
=1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操 作 | 可能的现象 | 结 论 |
A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
B | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和 Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3﹥Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
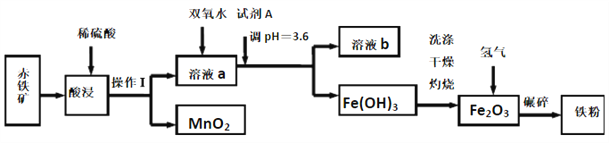
已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示, 请回答下列问题:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
(1)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____________________________。
(2)将pH控制在3.6的目的是_______。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=_______。
Cu(OH)2+2H+的平衡常数K=_______。
(3)加入双氧水时反应的离子方程式为_______。
(4)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
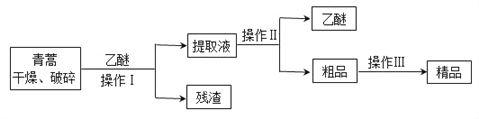
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是____________________。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、漏斗、_______,操作Ⅱ的名称是_______。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.20g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
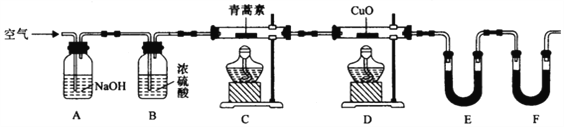
①装置E,F中盛放的物质分别是__________,____________。
②用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
③该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
①用单线桥表示上述反应中电子转移的方向和数目_____________________;
②浓盐酸在该反应中表现的性质是______(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是______________(填化学式);
④上述反应产生0.1 mol Cl2时,转移电子的物质的量为______________。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应中,氧化剂与还原剂的物质的量之比是_________________;
②KMnO4的氧化性比Cl2的氧化性______________;
③若在反应中生成了标况下2.24L氯气,则电子转移的个数是______NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把表面有氧化膜的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中金属离子为
A.Fe3+和Cu2+B.Fe2+和Cu2+C.Fe3+和Fe2+D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO42—===BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
④CO32—+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A. 只有③ B. ②③ C. ③⑤ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com