
����Ŀ����2L����ѹ�Ƶĺ����ܱ�������ͨ��2 molX(g)��1molY(g)��������Ӧ��2X(g)��Y(g)![]() 2Z(g) ��H<0�����ﵽƽ��ʱ���������ʵ�����Ϊԭ����0.85������ش��������⡣
2Z(g) ��H<0�����ﵽƽ��ʱ���������ʵ�����Ϊԭ����0.85������ش��������⡣
��1������Ӧ����5min�ﵽƽ�⣬��Y��ƽ����Ӧ����Ϊ__��
��2����ͬ�����½��з�Ӧ����t1ʱ�̣�ֻ�ı�����ijһ��������������ͼ����ͼ�ס�
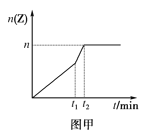
��n��0.9mol��t1ʱ�̸ı��������__(��ѡ���ţ�A.���� B.���� C.��ѹ D.��ѹ E.�Ӵ���)��t2__5min(��������������������������ͬ)��
��3���������������䣬ԭ����Ϊ��ѹ�������ﵽƽ���Z�����ʵ���__0.9mol��
��4���������ʵ�����Ϊ3mol������X��Y�����5L�����з�����Ӧ���ڷ�Ӧ������Z�����ʵ����������¶ȱ仯��ͼ�ҡ�
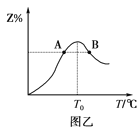
��A��B����Z��������Ӧ���ʵĴ�С��ϵ��__����������A��B��ʾ��
���¶�T<T0ʱ��Z%�������ԭ����___��
���𰸡�0.045 mol��L-1��min-1 E �� �� B��A ��Ӧ��û�дﵽƽ�⣬��Ӧ������Ӧ������У���Z%������
��������
��2L����ѹ�Ƶĺ����ܱ�������ͨ��2 molX(g)��1molY(g)��������Ӧ��
2X(g) ��Y(g)![]() 2Z(g)
2Z(g)
��ʼ 1 mol��L-1 0.5 mol��L-1 0
ת�� 2x x 2x
ƽ�� 1-2x 0.5-x 2x
�ﵽƽ��ʱ���������ʵ�����Ϊԭ����0.85������![]() ��x=0.225 mol��L-1���ﵽƽ��״̬ʱ��Z�����ʵ�����0.9mol������Ӱ�췴Ӧ���ʺ�ƽ���ƶ������ػش�
��x=0.225 mol��L-1���ﵽƽ��״̬ʱ��Z�����ʵ�����0.9mol������Ӱ�췴Ӧ���ʺ�ƽ���ƶ������ػش�
��1���������������� 5min��Y��Ũ�ȱ仯Ϊ0.225 mol��L-1����Y��ƽ����Ӧ����Ϊ![]() 0.045 mol��L-1��min-1��
0.045 mol��L-1��min-1��
��2����ͼ���֪����t1ʱ�̣��ı�������Ӧ���ʼӿ죬��n��0.9mol��˵��ƽ�ⲻ�ƶ��� A.������Ӧ���ȣ�����ƽ�������ƶ���Z�����ʵ�����С���ʲ�ѡA��
B. .������Ӧ���ȣ����·�Ӧ���ʼ�������ƽ�������ƶ���Z�����ʵ������ʲ�ѡB�� C. ������Ӧ�������ʵ�����С����ѹƽ�������ƶ���Z�����ʵ������ʲ�ѡC��
D.������Ӧ�������ʵ�����С����ѹƽ�������ƶ���Z�����ʵ�����С���ҷ�Ӧ���ʼ������ʲ�ѡD�� E.�Ӵ�������Ӧ���ʼӿ졢ƽ�ⲻ�ƶ�����ѡE��
ƽ�ⲻ�ƶ�����Ӧ���ʼӿ죬�ﵽƽ���ʱ�����̣�����t2��5min��
��3��������Ӧ�������ʵ�����С���������������䣬ԭ����Ϊ��ѹ�������൱�ڼ�ѹ��ƽ�������ƶ����ﵽƽ���Z�����ʵ�����0.9mol��
��4�����¶�Խ�ߣ���Ӧ����Խ�죬B����¶ȴ���A������A��B����Z��������Ӧ���ʵĴ�С��ϵ��B��A��
���¶�T��T0ʱ����Ӧ��û�дﵽƽ�⣬��Ӧ������Ӧ������У�����Z%������


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б���ʽ��д��ȷ����( )
A.NaHCO3�ĵ��뷽��ʽ��NaHCO3=Na++H++CO32-
B.HS����ˮ�ⷽ��ʽ��HS����H2O![]() H3O����S2��
H3O����S2��
C.CO32����ˮ�ⷽ��ʽ��CO32����2H2O![]() H2CO3��2OH��
H2CO3��2OH��
D.BaSO4�ij����ܽ�ƽ�����ʽ��BaSO4(s) ![]() Ba2+(aq)��SO42��(aq)
Ba2+(aq)��SO42��(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZulemaBorjas����Ƶ�һ���������γص�װ����ͼ��ʾ������˵����ȷ����(����)
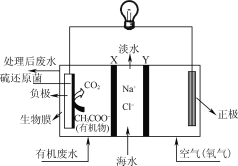
A. ��װ�ÿ����ڸ����¹���
B. X��Y����Ϊ�����ӡ�������ѡ���Խ���Ĥ
C. ������ӦΪCH3COO-+2H2O-8e-=2CO2��+7H��
D. ��װ�ù���ʱ������ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ1.0 L���������ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1 mol CO2��0.2 mol CO2���ڲ�ͬ�¶��·�ӦCO2(g)��C(s)![]() 2CO(g)�ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c(CO2)���¶ȵı仯��ͼ��ʾ(ͼ�Т�������������)������˵����ȷ����
2CO(g)�ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c(CO2)���¶ȵı仯��ͼ��ʾ(ͼ�Т�������������)������˵����ȷ����

A.��ӦCO2(g)��C(s) ![]() 2CO(g)����S��0����H��0
2CO(g)����S��0����H��0
B.��ϵ����ѹǿp����p��(״̬��)��2p��(״̬��)
C.��ϵ��c(CO)��c(CO��״̬��)��2c(CO��״̬��)
D.�淴Ӧ���ʣ�v��(״̬��)��v��(״̬��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ʼŨ��Ϊ1.0mol/L��Na2CrO4��Һ��c(Cr2O72-)��c(H+)�ı仯��ͼ��ʾ���ش��������⣺
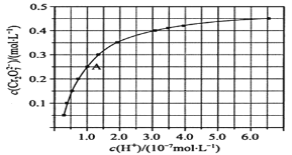
��1��CrO42-��Cr2O72-����Һ���ת�������ӷ���ʽ___��
��2����ͼ��֪��������Һ������ǿ��CrO42-��ƽ��ת����__(�����С�����䡱)������A(1.0��0.25)�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__��
��3�������¶ȣ���Һ��CrO42-��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H__0(����ڡ���С�ڡ����ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳɣ�
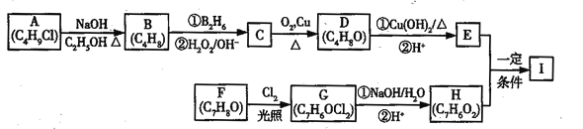
��֪������Ϣ��
��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��R��CH=CH2![]() R��CH2CH2OH��
R��CH2CH2OH��
�ۻ�����F�����ϵ�һ�ȴ���ֻ�����֣�
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______________________________��
��2��D�Ľṹ��ʽΪ_______________________________��
��3��E�еĹ���������Ϊ___________________________��
��4��F����G�Ļ�ѧ����ʽΪ__________________________���÷�Ӧ����Ϊ______________��
��5��I�Ľṹ��ʽΪ_________________________________��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ���������������ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������____�֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2:2:1��д��J������ͬ���칹��Ľṹ��ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ���ǣ� ��
A.���෯���̷�������Ѭ�ˣ��·���֮���ã���ľ��ʢ�����෯������![]() ��
��![]()
B.�ſ��ø�����Ƶ�ԭ����ͨ�����������е��Ҵ��������
C.������Ǧɽ���п�Ȫ������Ϊ��������ˮ��֮����ɵ������������漰�IJ����нᾧ
D.�ƹ�ʹ��úҺ���������Լ����������������̼���ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ��2NO(g)��2CO(g)![]() 2CO2(g)��N2(g) ��H����746.8kJ��mol��1���ɾ�������β�������Ҫͬʱ��߸÷�Ӧ�����ʺ�NO��ת��������ȡ�Ĵ�ʩ��
2CO2(g)��N2(g) ��H����746.8kJ��mol��1���ɾ�������β�������Ҫͬʱ��߸÷�Ӧ�����ʺ�NO��ת��������ȡ�Ĵ�ʩ��
A. �����¶� B. ����ѹǿ
C. �����¶�ͬʱ����N2 D. ��ʱ��CO2��N2�ӷ�Ӧ��ϵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ![]() C��
C��![]() C��̼Ԫ�ص�2�ֺ��أ����ǻ�Ϊͬλ��
C��̼Ԫ�ص�2�ֺ��أ����ǻ�Ϊͬλ��
B. ��ѧ�о��߿���������Ϊ������̬�Ĺ���̼�������µ�̼�ṹ������������ĭ�������������ƺ��࣬���ؼ�С�������д��ԡ�������ĭ̼��C60����ͬ��������
C.  ��
�� ��Ϊͬ���칹��
��Ϊͬ���칹��
D. �������ɿ�������![]() ����NO2���ֻ������
����NO2���ֻ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com