
下列有关铁及其化合物的离子方程式一定错误的是( )
A.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+===Fe3++3H2O
B.铁与稀硝酸反应:Fe+4H++NO ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
C.磁性氧化铁与浓盐酸反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
D.溴化亚铁溶液与氯水反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
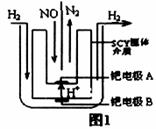 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)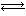 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙与醋酸:CaCO3+2H+=Ca2++ CO2↑+H2O
C. 盐酸与氢氧化钡溶液:H++OH-=H2O
D.铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子能大量共存的是( )
A.pH=12的溶液中:K+、Na+、Br-、AlO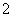
B.无色溶液中:H+、K+、MnO 、C2O
、C2O
C.c(Fe3+)=0.1 mol·L-1的溶液中:K+、H+、SCN-、I-
D.由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Na+、NH 、SO
、SO 、HCO
、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:10AgF+5Cl2+5H2 O===9AgCl+AgClO3+10HF+O2
O===9AgCl+AgClO3+10HF+O2
下列关于该反应的叙述不正确的是( )
A.该反应中,氧化剂与还原剂物质的量之比为95
B.当反应中有1 mol电子转移时,被还原氯气物质的量为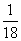 mol
mol
C.每产生1 mol O2时,被氧元素还原的氯气物质的量为2 mol
D.参加反应的水有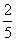 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO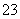 、NO
、NO 、SO
、SO 、SiO
、SiO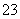 。现进行如下实验:
。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉 淀生成。
淀生成。
Ⅳ.向Ⅱ中所 得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为14,其离子方程式为Al+NO +OH-―→AlO
+OH-―→AlO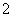 +NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO
+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO ,要消耗铝________g。
,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是( )
| 共价键 | H—H | F—F | H—F | H—Cl | H—I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)===2HF(g)
ΔH=-25 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO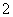
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.油脂是多种高级脂肪酸的甘油酯,要合理摄入
B.乙酸乙酯和高级脂肪酸甘油酯都能与氢氧化钠溶液发生反应,都有酸性
C.植物油能使酸性高锰酸钾溶液褪色
D.油脂的水解反应是取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com