
����Ŀ���������Ϊʳ���������Ӽ������⻯�����ǻ���������һ����Ҫԭ�ϡ���ԭ�������⻯�����ɵ����������ط�Ӧ���ɵ���غ��ü��ỹԭ���ã�����Ҫ������ͼ��
��ش��������⣺
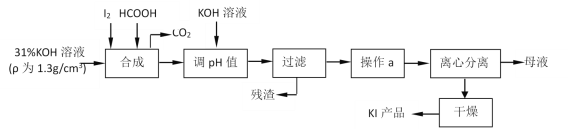
��1���жϡ��ϳɡ������У����Ƿ�����ȫ��Ӧ�ķ�����___��
��2��ʵ�����У����˲���Ҫ��һ�����������������С���������ָʢ�б�����Һ����ձ�עҺ�ڽ�����������___��___��
����a����������Ũ������ȴ�ᾧ��������KI���к������ʣ�___��
��3��д�����ϳɡ������У�HCOOH��������ӷ�Ӧ����ʽ��___��
��4���ⶨ��Ʒ��KI�����ķ����ǣ�
a����ȡ3.340g��Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�
b����ȡ25.00mL��Һ����ƿ�У���������KIO3��������ϡ�����ữ����ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������0.2400mol/L��Na2S2O3��Һ�ζ���������Һ���ƽ��ֵΪ10.00mL��
��֪��IO3-+I-+H+��I2+H2O��δ��ƽ����I2+2S2O32-��2I-+S4O62-��
�ٲⶨ��������������ʹ��ǰ�������Ƿ�©Һ����___��
�ڸ���Ʒ��KI����������Ϊ___��������3λ��Ч���֣�
��5����ѧ��ѡ�ü�ͥ�����е��йص��ϣ���ƾơ��״ס����͡�ζ���ȣ����ü�㷽��������Ƿ��Ǽӵ�ʳ�Ρ�ͨ��ʵ�������ֳ���ֻҪ��ʳ�ΰ�װ�ķ�ڴ���һ���⻯�ص�����ֽ�����ڴ���ע��ʹ�÷������ܼ�����α��������д�����ʹ��˵����___��
���𰸡�ȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮����δ��ȫ��Ӧ �������¶˽���������ֽ�� ©���¶˼�ڽ����ձ��ڱ� �⻯����ˮ�е��ܽ�����¶ȵ�Ӱ��ϴ� 3HCOOH+IO3-=I-+3H2O+3CO2�� 250mL����ƿ���ζ��� 0.994��99.4% ȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ���
��������
�ɵ���KOH��Ӧ���ɵ���غ��ü��ỹԭ���������KI��CO2��������ҺpH���˳�ȥ���ʣ���Һ������Ũ������ȴ�ᾧ�����롢����ɵõ��⻯�أ�
(1)���õ��ۼ�����Ƿ���ȫ��Ӧ��
(2)����ʱ��ʢ�б�����Һ����ձ�עҺ�ڽ������������������¶˽���������ֽ����©���¶˼�ڽ����ձ��ڱڣ�����a ����������Ũ������ȴ�ᾧ����˵��KI���ܽ�����¶ȵ�Ӱ��ϴ�
(3)�������֪���ỹԭ���������KI��CO2��ͬʱ����ˮ��
(4)�ⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ����Ϲ�ϵʽ�����㣻
(5)������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ��
(1)���õ��ۼ�����Ƿ���ȫ��Ӧ����������Ϊȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮����δ��ȫ��Ӧ��
(2)����ʱ��ʢ�б�����Һ����ձ�עҺ�ڽ������������������¶˽���������ֽ����©���¶˼�ڽ����ձ��ڱڣ�����a ����������Ũ������ȴ�ᾧ����˵��KI���ܽ�����¶ȵ�Ӱ��ϴ�
(3)���ỹԭ���������KI��CO2��ͬʱ����ˮ����Ӧ�����ӷ���ʽΪ3HCOOH+IO3����I��+3H2O+3CO2����
(4)�ٲⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ���ʴ�Ϊ��250mL����ƿ���ζ��ܣ�
��KIO3��KI��Ӧ��ȫ�Ļ�ѧ����ʽΪIO3��+5I��+6H+��3I2+3H2O��
��Ӧ�Ĺ�ϵʽΪ5I����3I2��6S2O32����n(Na2S2O3)��0.2400mol/L��0.01L��2.4��10��3mol��
�ɹ�ϵʽ��֪n(KI)��2.4��10��3mol��![]() ��2��10��3mol��
��2��10��3mol��
��3.340g��Ʒ�к���KI������Ϊ2��10��3mol��![]() ��166g/mol��3.32g��
��166g/mol��3.32g��
����Ʒ��KI����������Ϊ![]() ��0.994��99.4%��
��0.994��99.4%��
(5)������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ������Ϊȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ��Ρ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)��CO2(g)![]() 2CO(g)�ں���������һ���¶��´ﵽƽ�⣬�ٳ���CO2���ﵽ�µ�ƽ��ʱ���¶Ȳ��䣩����ԭƽ��ȣ�������ȷ����
2CO(g)�ں���������һ���¶��´ﵽƽ�⣬�ٳ���CO2���ﵽ�µ�ƽ��ʱ���¶Ȳ��䣩����ԭƽ��ȣ�������ȷ����
A.ƽ��������Ӧ�����ƶ�B.��������ƽ��Ħ����������
C.CO2��ת��������D.����Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǵڶ����ڲ���Ԫ�ػ�̬ԭ�ӵĵ����Ų�ͼ���ݴ�����˵��һ���������( )
B C
C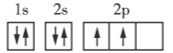
N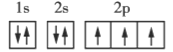 O
O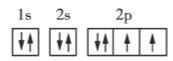
A.ÿ��ԭ�ӹ�������ֻ������2������
B.��������ͬһ�ܼ��IJ�ͬ�����ʱ���������ȵ���ռ��һ�����
C.ÿ���ܲ������е��ܼ��������ܲ�����
D.��һ��ԭ�ӹ������2�����ӣ���������״̬��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯����ɹ㷺����ҽҩ��ҵ�����ȡ�
(1)ʵ�����ú�����ȡI2ʱ������������Ϊ�����ա��ܽ⡢���ˡ�__��__������
(2)���պ���ʱ����Ҫ���żܡ��ƾ��ơ��������⣬����Ҫ��ʵ��������__��
(3)�����ˡ�����Һ�к�һ���������κ�̼���Ρ���Ҫ������Һ�е�I������ѡ����Լ���ϼ����Ⱥ�˳����__(ѡ����)��
a��AgNO3��Һ b��Ba(NO3)2��Һ c��BaCl2��Һ d��CaCl2��Һ
(4)�ں�������Һ�м���������ˮ��һ������I2�����ܴ���IO3�����벹���������麬I2��Һ���Ƿ���IO3����ʵ�鷽��(�ɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ)��
��ȡ������I2��Һ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���еⵥ�ʴ��ڣ�
��__��
(5)�ֽ�ˮ����SO2/I2ѭ�������÷����漰������ѧ��Ӧ��__��2H2SO4![]() 2SO2��+O2��+2H2O��__���봫ͳ�ķֽ�ˮ�ķ�����ȣ��������ŵ���__��ȱ����__��
2SO2��+O2��+2H2O��__���봫ͳ�ķֽ�ˮ�ķ�����ȣ��������ŵ���__��ȱ����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�װ��ͼ����������ȷ���ǣ� ��
A.װ��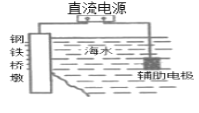 ���Ŷ�Ӧ���Դ�ĸ��������ܱ��������÷���������ӵ���������������
���Ŷ�Ӧ���Դ�ĸ��������ܱ��������÷���������ӵ���������������
B.װ��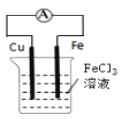 ���ܷ�Ӧʽ��Cu+2Fe3+��Cu2++2Fe2+
���ܷ�Ӧʽ��Cu+2Fe3+��Cu2++2Fe2+
C.װ��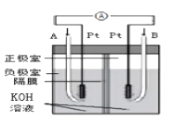 Ϊ����ȼ�ϵ�صĹ���ԭ����A��ͨ�������������
Ϊ����ȼ�ϵ�صĹ���ԭ����A��ͨ�������������
D.װ��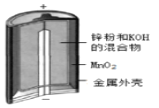 Ϊ����п�̸ɵ�أ��为���ĵ缫��ӦʽΪ��Zn-2e-=Zn2+
Ϊ����п�̸ɵ�أ��为���ĵ缫��ӦʽΪ��Zn-2e-=Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ҩ���������м��壬��ṹ��ʽ��ͼ�������й�������ȷ����
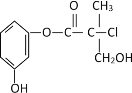
A.���л�������ˮ�ɷ��ӳɷ�Ӧ
B.���л�����Ũ�����Ϲ��ȿɷ�����ȥ��Ӧ
C.1 mol���л���������NaOH��Һ��Ӧ�������3molNaOH
D.���л��ᆳ��������������������ͭ����Һ��������ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH4��2SO4��һ�������·������·�Ӧ��4��NH4��2SO4![]() N2����6 NH3����3SO2����SO3����7H2O ����Ӧ�������ͨ��һ������BaCl2��Һ�У�������Һ�а�ɫ�������ɣ����в����������Һ���ݳ������鷢�ִ���Һ���ݳ���������ɫ����ζ����Һ���Ȼ���ǡ����ȫ��Ӧ������˵����ȷ����
N2����6 NH3����3SO2����SO3����7H2O ����Ӧ�������ͨ��һ������BaCl2��Һ�У�������Һ�а�ɫ�������ɣ����в����������Һ���ݳ������鷢�ִ���Һ���ݳ���������ɫ����ζ����Һ���Ȼ���ǡ����ȫ��Ӧ������˵����ȷ����
A�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��1
B�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��2
C�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��3
D������Һ���ݳ�������ֻ��N2�����������Һ������ֻ�н϶��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������ij��̬����������һ��������ͣ�ȼ�պ�ָ���ԭ�¶ȣ�20�棩��ѹǿ��С��ԭ����һ�룬����NaOH��Һ����ȫ�������գ����������Ϊ�� ��
A.C2H4B.C2H6C.C3H6D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ��������������P��M��N������������������Ԫ����ɵĻ�������Ǵ���ת����ϵQ![]() P+M+N��P��ʹʪ��ĺ�ɫʯ����ֽ������M�����Ԫ��λ��ͬһ���壬N���³�ѹ��ΪҺ�塣����˵������ȷ���ǣ� ��
P+M+N��P��ʹʪ��ĺ�ɫʯ����ֽ������M�����Ԫ��λ��ͬһ���壬N���³�ѹ��ΪҺ�塣����˵������ȷ���ǣ� ��
A.ԭ�Ӱ뾶��Y��Z��W��X
B.����̬�⻯������ȶ��ԣ�Z��Y
C.����M����Ư����
D.Q������ǿ����Һ��Ӧ��������ǿ����Һ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com