
【题目】国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如右图),有关说法正确的是( )
A.锰价电子排布为3d74s0
B.Bi是d区金属
C.该晶体的化学式为MnBi
D.该合金堆积方式是简单立方
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
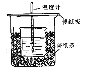
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”、“不相等”),所求中和热___(填“相等”、“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 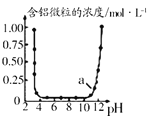 表示
表示![]() 与
与![]() 反应时含铝微粒浓度变化曲线,图中a点溶液中含大量
反应时含铝微粒浓度变化曲线,图中a点溶液中含大量![]()
B. 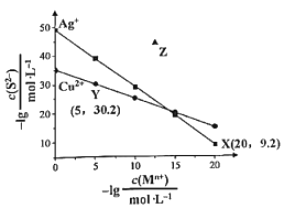 可知
可知![]() 平衡常数很大,反应趋于完全
平衡常数很大,反应趋于完全
C.  为一种高分子结构片断,可知该高分子的结构简式为
为一种高分子结构片断,可知该高分子的结构简式为
D.  反应①比反应②的速率慢,与相应正反应的活化无关
反应①比反应②的速率慢,与相应正反应的活化无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原子结构知识回答:
(1)![]() 基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
(2)基态的![]() 原子有______ 个未成对电子,
原子有______ 个未成对电子,![]() 的外围电子排布图为______________。
的外围电子排布图为______________。
(3)四种元素![]() 、K、O、
、K、O、![]() 中第一电离能最小的是 _____,电负性最大的是 ______。
中第一电离能最小的是 _____,电负性最大的是 ______。
(4)下列有关微粒性质的排列顺序中,错误的是 ______ 。
A.元素的电负性:![]()
![]() 元素的第一电离能:
元素的第一电离能:![]()
C.离子半径:![]()
![]() 原子的未成对电子数:
原子的未成对电子数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
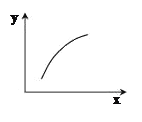
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小B. BaO量不变C. 氧气压强不变D. BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是
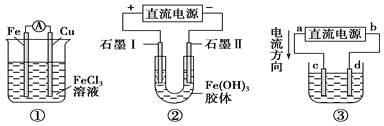
A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com